„bacteriile benefice-probioticele din intestin sunt cunoscute acum sa fie raspunzatoare de pana la 85 la suta din răspunsul imunitatii, pentru a elibera vitamine anti-cancer (cum ar fi biotină, B-12, acid folic, vitamina K) din alimente si chiar pentru a produce un compus (butirat de sodiu), care face ca celulele canceroase sa se autodistruga.
bacteriile benefice funtioneaza imperfect cand aciditatea intestinului crește. (Click aici pentru a citi despre bacteriile benefice -probiotice, prebiotice si chimioterapie.)”
tot fiind iarna , nu uitati de muraturi de fermentatie naturala, MOAREA DE VARZA 🙂
si nici de iaurtul/branza cu ulei de in din mixul Dr Budwig
bacteriile intestinale pot amplifica dramatic imunoterapia cancerului
Prin introducerea unei anumite tulpini de bacterii in tractul digestiv al soarecilor cu melanom, cercetatorii de la Universitatea din Chicago (studiul citat mai jos) au fost in masura sa impulsioneze capacitatea sistemului imunitar al animalului de a ataca celulele tumorale.
Câștigurile au fost comparabile cu tratamentul cu medicamente anti-cancer cunoscute sub numele de inhibitori ai punctelor de control, cum ar fi anticorpii anti-PD-L1.
inhibitori ai punctelor de control
Celulele T, un tip de celule albe din sânge, sunt caractere centrale în răspunsul imun. Ele vânează celule infectate sau canceroase și le distrug.
Totuși, celulele tumorale se pot atașa la receptorii specifici ai celulelor T, oprindu-le și făcându-le inerte.
Inhibitorii de puncte de control, cum ar fi anticorpii anti-PD-L1 sau CTLA-4, blochează capacitatea celulei tumorale de a se atașa la celulele T. Acest lucru, la rândul său, menține celulele T active și vânătoarea de celule defecte sau eronate.
Deși inhibitorii de puncte de control s-au dovedit de succes în tratarea unui număr de tipuri de cancer, numai aproximativ 1 din 3 pacienți au un răspuns viguros. Acest lucru a speriat cercetătorii.
Combinatia de doze orale de bacterii si injectii cu anticorpi anti-PD-L1 aproape a abolit cresterea tumorala, cercetatorii au raportat online in revista Science.
„Rezultatele noastre demonstreaza in mod clar un rol semnificativ, desi neasteptat, pentru bacteriile intestinale specifice in imbunatatirea raspunsului sistemului imunitar la melanom si, eventual, multe alte tipuri de tumori”, a declarat directorul de studiu Thomas Gajewski, MD, PhD, profesor de medicina si patologie la Universitatea din Chicago.
„Comunitatea a recunoscut recent legături strânse între microbiomul intestinal și sistemul imunitar”, a spus el. Aceasta constatare ofera o modalitate noua de a exploata aceasta conexiune, de imbunatatire a imunoterapiei prin modularea selectiva bacterii intestinale.
Inhibitorii de puncte de control cum ar fi ipilimumab, nivolumab și pembrolizumab au avut un impact dramatic asupra tratamentului mai multor tipuri de tumori, incluzând melanomul, cancerul pulmonar, cancerele capului și gâtului și altele. Dar doar o minoritate de pacienți – o treime sau mai puțin – au un răspuns energic. Cercetătorii de cancer s-au întrebat de ce beneficiază atât de puțini.
Gajewski și colegii au găsit un model similar la șoarecii pe care îi folosesc pentru cercetarea cancerului.
Ei au observat că șoarecii achiziționați de la Jackson Laboratory (JAX) au avut tendința de a avea un răspuns imun spontan robust pentru tumorile mici de melanom implantate sub piele.
Șoarecii de la Taconic Biosciences (TAC) au prezentat doar un răspuns imun slab.
Dar când cercetătorii au pus șoarecii din ambele surse în cuști timp de trei săptămâni, au descoperit că co-localizarea „elimină complet diferențele în creșterea tumorilor”, a spus Gajewski. Acest lucru le-a făcut să suspecteze că prin împărtășirea expunerii la diferite tipuri de bacterii, șoarecii TAC au achiziționat microbi de la șoareci JAX care au îmbunătățit cumva imunitatea lor față de tumori.
Ei și-au confirmat suspiciunea prin colectarea de materii fecale de la șoareci JAX și transferându-i în stomacul șoarecilor TAC. A mers. Soarecii TAC tratați au fost apoi capabili să monteze un răspuns imun puternic și să întârzie creșterea tumorii. Procesul invers, transferarea bacteriilor fecale de la TAC la șoareci JAX nu a avut efect.
Apoi, au comparat efectele transferului bacterian cu un inhibitor al punctelor de control, anticorpii anti-PD-L1)imunoterapie). Ei au descoperit că introducerea bacteriilor intestinale a fost la fel de eficientă ca tratarea acestora cu anticorpi anti-PD-L1, ceea ce a dus la o creștere semnificativ mai lentă a tumorii. Combinarea beneficiilor asociate cu bacteriile cu tratament anti-PD-L1 a îmbunătățit dramatic controlul tumorilor.
Așa că au început să caute bacteriile specifice care au făcut diferența. Ei au identificat microbi din tracturile digestive ale șoarecilor JAX și TAC prin secvențierea pe scară largă. Deși au existat diferențe semnificative în 254 de familii taxonomice de bacterii din cele două seturi de șoareci, trei grupuri au fost proeminente.
Când au testat efectele fiecărui grup bacterii intestinale asupra sistemului imunitar al șoarecilor, un grup, Bifidobacterium, a ieșit in evidenta. În două săptămâni de la administrarea orală, șoarecii TAC care au primit doar specii de Bifidobacterium au avut o creștere marcantă a răspunsurilor celulelor T antitumorale.
Șoarecii tratați doar cu Bifidobacterium, mai degrabă decât transferul complet de fecale, au prezentat controlul tumorii comparabil cu cei care au primit amestecul complet. Efectul a fost durabil. șoareci TAC expuși la tumori la șase săptămâni după transferul de Bifidobacterium au fost în continuare capabili de a monta un răspuns imun robust.
Teste suplimentare au arătat că Bifidobacterium nu a părăsit intestinul. Ei păreau să declanșeze răspunsul imun prin interacțiunea cu celulele dendritice în roaming. Aceste celule de captare detectează și procesează amenințările potențiale și le prezintă celulelor T. Cercetatorii suspecteaza ca Bifidobacterium colonizeaza un compartiment in intestine. Acest lucru le permite să interacționeze cu celulele care interacționează cu celulele dendritice, care activează celulele T care ucid tumorile.
Pot exista alte bacterii care contribuie, de asemenea, la acest proces, spun cercetatorii, fie pozitiv, fie negativ. Ei investighează alte bacterii care ar putea influența alte terapii imune, cum ar fi calea CTLA-4, exploatată de ipilimumab.
Un al doilea studiu – de la Institutul Gustave Roussy din Paris, publicat în aceeași ediție a Science – a constatat că antibioticele ar putea perturba efectele antitumorale ale ipilimumabului. Reumplerea microbilor pierduți în șoareci fără germeni și cu antibiotice a restaurat efectele anti-cancer ale medicamentului.
Bifidobacteriile se găsesc în intestin, gură și vagin
Dozele orale de bifidobacterii pot ameliora diareea infantilă
Acestea fermentează zaharurile pentru a produce acid lactic în intestinul nostru.
Microbii intestinului ofera un tratament impotriva cancerului
Inhibitorii de puncte de control, care au scopul de a dezlănțui puterea sistemului imunitar asupra tumorilor, sunt unele dintre cele mai impresionante tratamente noi pentru cancer. Dar majoritatea pacienților care le primesc nu beneficiază. Două studii noi despre șoareci sugerează un motiv surprinzător de ce – acești oameni ar putea să nu aibă amestecul corect de bacterii în curajul lor. Ambele studii demonstrează că compoziția microbiomei intestinale – roiurile de microorganisme care locuiesc în mod natural în intestine – determină cât de eficiente sunt aceste imunoterapii de cancer.
Studiile sunt primele care leagă denizenele noastre intestinale de potența inhibitorilor de puncte de control, medicamente care contracară unul dintre trucurile de supraviețuire a cancerului. Pentru a reduce atacurile asupra propriilor țesuturi, celulele imune poartă receptori care își formează activitatea. Dar celulele tumorale pot stimula, de asemenea, acesti receptori, prevenind sistemul imunitar de a le ataca. Inhibitorii de puncte de control cum ar fi ipilimumab – care a fost pe piață începând cu 2011 – nivolumab, și pembrolizumab opresc celulele tumorale de la stimularea receptorilor.
Noua lucrare ar putea schimba modul în care medicii folosesc medicamentele. Ambele studii arata in mod convingator ca microbii pot afecta tratamentele, spune imunologul Yasmine Belkaid de la Institutul National de alergie si de boala infectioasa din Bethesda, Maryland, care nu a fost conectat la noile studii. In trecut, cercetatorii au cautat, de obicei, mutatii in genomul pacientilor care ar putea explica de ce un anumit inhibitor de punct de control nu funtioneaza, spune biolog molecular Scott Bultman de la Universitatea din Carolina de Nord Scoala de Medicina din Chapel Hill. Noile rezultate sunt incurajatoare, spune el, deoarece „este mai usor sa schimbi microbiota intestinului decat genomul tau”.
Inhibitorii de puncte de control pot diminua tumorile și pot extinde viața pacienților, uneori de ani. Cu toate acestea, doar o fracțiune de destinatari se îmbunătățește. Aproximativ 20% din pacienții cu melanom tratați cu ipilimumab trăiesc mai mult, de exemplu. Cercetătorii nu știu ce îi deosebește de ceilalți 80%.
Un efect secundar Ipilimumab declanșează adesea colita, o inflamație a intestinului gros, unde o parte din microbiom trăiește. Acest efect secundar sugerează că imunoterapia ce foloseste inhibitorii de puncte de control și microbiomele interacționează. Urmarind aceasta posibilitate, cercetatorii au urmarit cresterea tumorilor implantate la soareci fara bacterii intestinale. Inhibitorul de punct de control pe care l-au testat a fost mai puțin puternic la animale.
Analiza ulterioară efectuată de Zitvogel și de colegi a sugerat că anumite bacterii din genurile Bacteroides și Burkholderia au fost responsabile pentru efectul antitumoral al microbiomei. Pentru a confirma aceasta posibilitate, cercetatorii au transferat bacterii iintestinale la soareci care nu aveau bacterii intestinale, fie prin hranirea cu bacterii intestinale animalelor, fie prin administrarea fecalelor bogate in Bacteroide ale unor pacienti tratati cu ipilimumab. În ambele cazuri, un aflux de bacterii intestinale a întărit răspunsul animalelor la un inhibitor al unui punct de control(tratament imunitar).
„Sistemul nostru imunitar poate fi mobilizat de către trilioanele de bacterii pe care le avem în intestin”, spune Zitvogel.
Imunologul Thomas Gajewski de la Universitatea din Chicago (UC) din Illinois si colegii sai au ajuns la o concluzie similara dupa ce au observat o diferenta intre soarecii obtinuti de la doi furnizori.(a se vedea mai sus)
Cele două echipe au implicat diferite grupuri bacteriene, dar acest lucru nu îngrijorează microimmunologul Christian Jobin de la Colegiul de Medicină al Universității din Florida din Gainesville. „Diferite droguri, diferite bug-uri, dar același obiectiv”, spune el.
El adauga ca noua lucrare completeaza o pereche de studii din 2013 care au demonstrat ca microbiomul afecteaza cat de bine chimioterapia functioneaza. http://science.sciencemag.org/content/342/6161/971
Descoperirile „deschid noi modalitati de a imbunatati terapia”, spune Cynthia Sears, specialist in boli infectioase la Scoala de Medicina Johns Hopkins din Baltimore, Maryland. De exemplu, s-ar putea dovedi posibila reacția antitumorală a unui pacient cu probiotice.
Dar cercetătorii văd și câteva blocaje potențiale. După cum notează Zitvogel, agențiile de reglementare din Statele Unite și Europa nu au aprobat utilizarea probioticelor pentru pacienții cu cancer. :))) pacientii cu cancer pot manca orice numai sa stea departe de alimente sanatoase!!!
De asemenea, este neclar modul in care microbii stimuleaza raspunsul imun – bacteriile intestinale sunt esentiale pentru dezvoltarea sistemului imunitar, dar cercetatorii nu sunt siguri cum isi schimba functia in animalele mature.
Și oamenii de știință au învățat doar cum să treacă cu microbiomele. Nu este clar ca putem manipula in mod semnificativ microbiota si de a crea efecte pozitive asupra sanatatii, spune Sears. Cu toate acestea, spun cercetatorii, studiile sugereaza ca am putea avea alti aliati puternici noi in lupta impotriva cancerului.
doi: 10.1126 / science.aad7398
http://www.sciencemag.org/news/2015/11/gut-microbes-give-anticancer-treatments-boost
Bacteriile acid lactic (Lactobacillus)sunt superioare celor din specia Bifido in ceea ce priveste stiumularea imunitatii
https://www.ncbi.nlm.nih.gov/pubmed/17641467
Ingestia de bacterii intestinale Lactobacillus rhamnosus GG pot stimula activitatea altor bacterii intestinale,inclusiv Bacteroide, Eubacterium, Faecalibacterium, Bifidobacterium și Streptococcus. Aceste bacterii intestinale s-au dovedit a avea o serie de beneficii la om, inclusiv promovarea unui sistem imunitar sănătos.
https://www.sciencedaily.com/releases/2015/04/150416132021.htm
Emiley A. Eloe-Fadrosh, Arthur Brady, Jonathan Crabtree, Elliott F. Drabek, Bing Ma, Anup Mahurkar, Jacques Ravel, Miriam Haverkamp, Anne-Maria Fiorino, Christine Botelho, Irina Andreyeva, Patricia L. Hibberd, Claire M. Fraser. Functional Dynamics of the Gut Microbiome in Elderly People during Probiotic Consumption. mBio, 2015; 6 (2): e00231-15 DOI: 10.1128/mBio.00231-15
studii care leaga flora intestinala de imunitate si efect antitumoral:
1.Imunologie tumorala – Bacteriile intestinale sunt la comandă
Doua lucrari din stiinta prezinta dovezi la soareci ca anumite specii de bacterii intestinale pot conduce raspunsuri imunitare antitumorale si sa moduleze raspunsurile la blocada de control imunitar.
Sivan și colab. a investigat efectele microbiomei asupra răspunsurilor la blocarea căii de proteine moarte celulară 1 (PD1) programată.
Gemma K. Alderton
Nature Reviews Immunology 16, 5 (2016) doi: 10.1038 / nr.2015.13
Publicat online 14 decembrie 2015 Corectat online 18 decembrie 2015
Lara Crow / NPG
https://www.nature.com/nri/journal/v16/n1/full/nri.2015.13.html
2.Immunotherapia NU functioneaza? Verificati Microbiota/Flora intestinala
Microbii florei intestinale au urcat la proeminență ca modulatori cheie ai imunității gazdă, ridicând posibilitatea ca aceștia să poată influența rezultatul imunoterapiei de cancer. Două studii recente se referă la această întrebare prin identificarea bacteriilor specifice ale intestinului drept onducatori ai imunoterapiei de blocare a punctelor de control în modelele preclinice de tumoră.
Punctul imunologic de control (denumit în continuare „punctul de control”) este o zonă cu creștere rapidă a dezvoltării medicamentelor oncologice și a obținut un succes remarcabil în cadrul clinicii (Mahoney et al., 2015). Strategiile de blocare a punctelor de control sunt concepute pentru a dezlănțui imunitatea anti-tumorală a gazdei prin blocarea semnalelor inhibitoare („puncte de control”) care în mod normal acționează pentru a preveni răspunsurile imune necorespunzătoare. În prezent, cele două obiective clinic importante de control sunt CTLA-4 (proteina 4 asociată cu limfocite T citotoxice) și axa PD1 (programată de moarte 1) / PD-L1 (programată moarte-ligand 1).
Mai multi anticorpi care vizează aceste molecule au fost aprobate de către Administrația SUA pentru Alimentație și Medicamente, inclusiv ipilimumab (anti-CTLA-4), pembrolizumab (anti-PD1) și nivolumab (anti-PD1) (Mahoney et al., 2015). În ciuda eficacității lor impresionante, o mare parte din pacienți cancer nu răspund la aceste medicamente. O provocare cheie este de a înțelege variabilitatea răspunsurilor pacientului în scopul identificării strategiilor pentru a spori eficacitatea blocării punctului de control și pentru a îmbunătăți predicția rezultatelor pacientului.
O zonă fiziologică care se poate intersecta cu blocarea punctului de control este microbiomul (flora intestinala) gazdă. Corpul uman cuprinde mai mult de 100 de miliarde de bacterii care variază foarte mult în diversitatea filogenetică dintre indivizi. Aceste microorganisme se angajează într-o comunicare constantă în ambele sensuri cu sistemul imunitar dens populat, care este esențial pentru dezvoltarea și funcția imună a gazdei (Ivanov și Honda, 2012). Studiile recente au demonstrat că comensamentele intestinale sunt necesare pentru controlul eficient al tumorilor utilizând terapii convenționale cum ar fi ciclofosfamida și oxaliplatina, ambele depind de activarea imunității antitumorale pentru efectele lor terapeutice (Iida și colab., 2013, Viaud și colab., 2013 ). Această temă este dezvoltată în continuare prin două articole recente publicate în Science (Sivan et al., 2015, Vétizou și colab., 2015), care ilustrează rolul important al microbilor intestinali în promovarea eficacității terapiilor imunitare anti-PD-L1 și anti-CTLA- 4 .
Terapiile anti-PD-L1 și anti-CTLA4 sunt mai eficiente la pacienții care prezintă dovezi ale imunității endogene antitumorale înaintea tratamentului, în conformitate cu ideea că ele promovează imunitatea pre-existentă, în loc să inducă răspunsuri de novo (Ji et al. 2012, Tumeh și colab., 2014). Cu toate acestea, de ce numai unii pacienți dezvoltă astfel de răspunsuri nu este clar.
Pentru a determina dacă microflora intestinală influențează acest proces, Sivan și colab. (2015) au comparat cinetica de creștere a celulelor de melanom B16.SIY (SIY este un antigen model exprimat prin această linie celulară) la șoareci C57BL / 6 crescuți în două unități diferite cu comunități bacteriene distincte: Taconic Farms (TAC) și Jackson Laboratory JAX). Au fost observate diferențe clare, cu șoareci TAC generând tumori mai agresive decât șoarecii JAX. În schimb, la șoarecii JAX s-au observat frecvențe crescute ale celulelor T CD8 + specifice cu infiltrare a tumorii. Co-locuirea a ablat aceste diferențe, sugerând că un element microbian transferabil poate fi responsabil. Într-adevăr, atunci când fecalele de la șoarecii JAX au fost transferați la șoareci TAC, sarcina tumorală a fost redusă în timp ce răspunsurile celulelor T CD8 + specifice tumorii au fost amplificate la șoarecii TAC. În schimb, fecalele TAC au avut un efect redus asupra destinatarilor JAX. Mai mult, eficacitatea imunoterapiei anti-PD-L1 la șoareci TAC a fost semnificativ îmbunătățită atunci când șoarecii au primit fecale(bacterii intestinale) de la donatorii JAX. Autorii au continuat să identifice membrii / bacterii din genul Bifidobacterium ca conducatoi candidați la respingerea tumorii la șoarecii JAX. Genul Bifidobacterium include specii anaerobe gram-pozitive care sunt considerate pe larg ca fiind benefice; într-adevăr, ele sunt constituenți primari ai formulărilor pro biotice care au demonstrat eficacitatea în tratarea bolii inflamatorii intestinale (Vieira et al., 2013). Gavajul oral, cu o creștere Bifidobacterium cocteil a afectat cresterea tumorii, la șoareci TAC, și adăugarea anti-PD-L1 a îmbunătățit în continuare controlul asupra tumorii. Critic, efectul terapeutic al suplimentării cu Bifidobacterium și terapia anti-PD-L1 a fost strict dependent de celulele T CD8 +.
Vétizou și colab. (2015)) au făcut observații similare, observând că eficacitatea anti-CTLA-4 a fost neglijabilă la șoarecii fără germeni sau cu antibiotice. Ca și șoarecii TAC din Sivan și colab. (2015)), eșecul terapeutic a fost asociat cu răspunsuri reduse ale celulelor T efectoare după tratamentul anti-CTLA-4. Intrigant, terapia anti-CTLA-4 a determinat modificări în microbiota intestinală, caracterizată prin creșterea abundenței relative a speciilor specifice de Bacteroides în mucoasa intestinală mică, dintre care unele păreau a fi ținte specifice ale răspunsurilor celulelor T. În timp ce motivele pentru acest lucru nu sunt în întregime clare, autorii prezintă date care sugerează că terapia anti-CTLA-4 declanșează apoptoza crescută și proliferarea celulelor epiteliale intestinale, care ar putea influența în mod efectiv microbiota locală.
Colonizarea șoarecilor tratați cu antibiotice sau fără germeni cu bacterii intestinale B. thetaiotaomicron sau B. fragilis a îmbunătățit răspunsurile la anti-CTLA4, demonstrând că aceste bacterii sunt suficiente pentru a promova eficacitatea blocării punctului de control.
În mod remarcabil, autorii au observat, de asemenea, frecvențe crescute ale celulelor T CD4 + cu reacție Bacteroides la pacienții cu melanom în urma tratamentului cu ipilimumab. Profilarea fecalelor post-ipilimumab pentru compoziția microbiană a evidențiat trei grupe de pacienți, dintre care două au fost dominate de diferite specii de Bacteroides. Când aceste fecale/bacterii au fost transferate la șoareci fără germeni(intestinali), un grup a promovat în mod clar eficacitatea antitumorală a terapiei anti-CTLA-4; acesti șoareci au fost singurele animale care au extins selectiv bacteriile B. thetaiotaomicron și B. fragilis.
Aceste studii oferă un argument convingător că microbiomele intestinale pot influența imunitatea antitumorală (vezi Figura 1), dar cum este mediată aceasta?
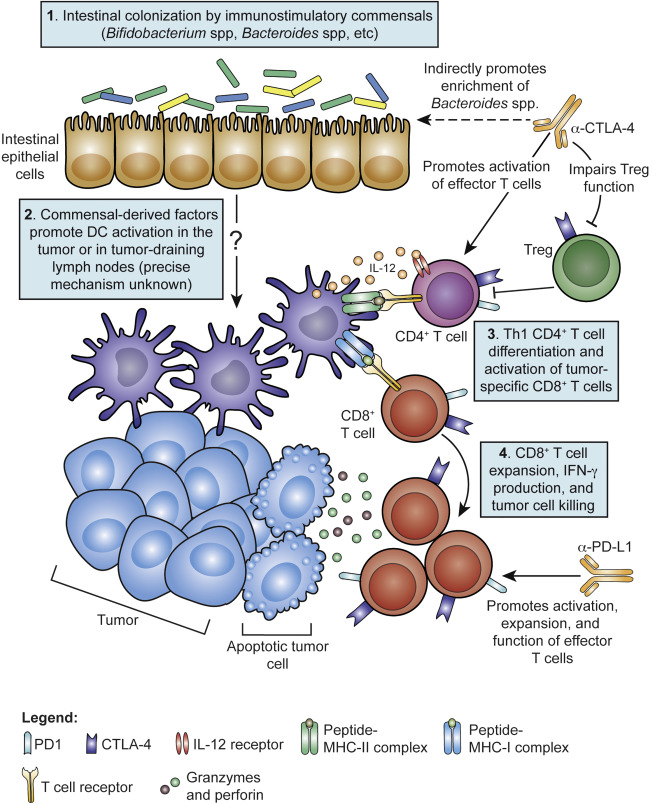
Un aspect important este că ambele studii au utilizat modele de tumori subcutanate, ceea ce înseamnă că bacteriile reziduale intestinale au exercitat un efect sistemic.
Deși nici un studiu nu oferă un mecanism complet, ambele demonstrează că poate fi implicată o modificare a activării celulelor dendritice (DC).
Sivan și colab. (2015) a constatat că, în comparație cu șoarecii TAC sensibili la tumori, CD11c + DC în tumorile de la șoareci JAX sau șoarecii TAC colonizați cu Bifidobacterium au exprimat nivele mai ridicate ale complexului histocompatibilității clasa I și clasa II (MHC) imunitate tumorală.
Mai mult, în raport cu șoarecii TAC nativi, DC -celule dendrice purificate din țesuturile limfoide ale șoarecilor TAC colonizați cu JAX sau Bifidobacterium au condus la o activare mai eficientă a celulelor T CD8 +(celule imunitare) in vitro.
Foarte important, acest lucru nu a fost datorat translocării bacteriene la locurile extra-intestinale.
Vétizou și colab. (2015)) a observat în mod asemănător că monocolonizarea șoarecilor fără germeni (intestinali) cu bacterii B. fragilis a amplificat activarea celulelor dendrice DCs intratumorale și a răspunsurilor Th1 în ganglionii limfatici care dau tumora.
Exact modul în care aceste bacterii promovează răspunsurile imune la locurile îndepărtate rămâne neclar, dar poate implica celule dendrice primare DC prin factori solubili din punct de vedere sistemic. Elucidarea mecanismelor cheie va fi critică pentru exploatarea terapeutică rațională a microflorei intestinale și dezvoltarea compușilor derivați de bacterii din intestin care ar putea servi drept adjuvanți imunoterapeutici.
În mod colectiv, rezultatele Sivan și colab. (2015)) și Vétizou și colab. (2015)) demonstrează că microbiota/flora intestinală poate influența rezultatul imunoterapiei tumorale, aparent prin amplificarea activării celulelor dendrice DC și amorsarea ulterioară a răspunsurilor celulelor T antitumorale.
Acesta reprezintă un nou concept important pentru a explica eterogenitatea imunității antitumorale observate în clinică.
Deși ambele studii se concentrează pe genele bacteriene specifice, pare foarte probabil că alte bacterii intestinale ar putea juca roluri similare. Într-adevăr, Vétizou și colab. (2015)) a observat că bacteria Burkholderia cepacia ar putea promova, de asemenea, răspunsurile anti-CTLA-4. În mod similar, fecalele dominate de speciile de Prevotella de la pacienții tratați cu ipilimumab au amplificat semnificativ (dar modest) răspunsurile imunoterapeutice anti-CTLA-4 atunci când sunt transferate la șoareci fără germeni intestinali(de exemplu cei tratati cu antibiotice).
În cele din urmă, un efect advers important al terapiei anti-CTLA-4 este inducerea colitei, datorată cel puțin parțial perturbării funcției antiinflamatorii a celulelor T regulate intestinale (Read et al., 2006). Totuși, Vétizou și colab. (2015) a constatat că efectul anti-tumoral al coloniilor de B. fragilis sau Burkholderia nu a venit la costul colitei agravate. Acest efect surprinzător de imunomodulator selectiv are implicații clare pentru îmbunătățirea eficacității și siguranței blocadei de control.
Având în vedere ușurința colectării scaunelor de la donatorii umani, aceste studii vor stimula, fără îndoială, un efort robust de a profila microbiomul intestinal al pacienților supuși blocării punctului de control(imunoterapie).
Acest lucru ar putea produce atât biomarkeri pentru prezicerea răspunsului terapeutic și strategii pentru a maximiza beneficiul clinic al imunoterapiei de cancer.
Studiul a fost susținut de o fracțiune postdoctorală a Institutului Irvington (Institutul de Cercetare a Cancerului). F.P. este susținut de un premiu Wellcome Trust Investigator Award.
- Kennedy Institute of Rheumatology, University of Oxford, Oxford OX3 7LF, UK.
- Kennedy Institute of Rheumatology, University of Oxford, Oxford OX3 7LF, UK; Translational Gastroenterology Unit, Experimental Medicine Division, University of Oxford, John Radcliffe Hospital, Oxford OX3 9DU, UK. Electronic address: fiona.powrie@kennedy.ox.ac.uk.
https://www.ncbi.nlm.nih.gov/pubmed/26678336
3.Imunoterapia anticanceroasă prin blocarea CTLA-4 se bazează pe microbiota intestinală
Anticorpii care vizează CTLA-4 au fost utilizați cu succes ca imunoterapie pentru cancer. Aflăm că efectele antitumorale ale blocadei CTLA-4 depind de specii distincte de Bacterii intestinale.
La șoareci și la pacienți umani, răspunsurile celulelor T specifice pentru B. thetaiotaomicron sau B. fragilis au fost asociate cu eficacitatea blocării CTLA-4.
Tumorile la șoarecii tratați cu antibiotice sau fără germeni nu au răspuns la blocarea CTLA. Acest defect a fost depășit prin gavaj cu B. fragilis, prin imunizare cu polizaharide B. fragilis sau prin transferul adoptiv al celulelor T specifice B. fragilis.
Transplantul microbian fecal de la om la șoareci a confirmat faptul că tratamentul pacienților cu melanom cu anticorpi împotriva CTLA-4 a favorizat creșterea B. fragilis cu proprietăți anticanceroase. Acest studiu relevă un rol-cheie pentru Bacteroizi în efectele imunostimulatoare ale blocadei CTLA-4.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4721659/
Marie Vétizou, 1,2,3 Jonathan M. Pitt, 1,2,3 Romain Daillère, 1,2,3 Patricia Lepage, 4 Nadine Waldschmitt, 5 Caroline Flament, 1,2,6 Sylvie Rusakiewicz, 1,2,6 Bertrand Routy, 1,2,3,6 Maria P. Roberti, 1,2,6 Connie PM Duong, 1,2,6 Vichnou Poirier-Colame, 1,2,6 Antoine Roux, 1,2,7 Sonia Becharef, 1, 2, 6, Silvia Formenti, 8, Encouse Golden, 8 Sascha Cording, 9 Gerard Eberl, 9 Andreas Schlitzer, 10 Florent Ginhoux, 10 Sridhar Mani, 11 Takahiro Yamazaki, 1,2,6 Nicolas Jacquelot, P. Enot, 1,7,12 Marion Bérard, 13 Jérôme Nigou, 14,15 Paule Opolon, 1 Alexander Eggermont, 1,2,16 Paul-Louis Woerther, 17 Elisabeth Chachaty, 17 Nathalie Chaput, 1,18 Caroline Robert, 1,16,19 Christina Mateus, 1,16 Guido Kroemer, 7,12,20,21,22 Didier Raoult, 23 Ivo Gomperts Boneca, 24,25, * Franck Carbonnel, 3,26, * Mathias Chamaillard, 5, * și Laurence Zitvogel1,2,3,6, †
1 Institutul de Cancerologie Gustave Roussy Campusul de Cancer (GRCC), 114 rue Edouard Vaillant, 94805 Villejuif, Franța
2INSERM U1015, GRCC, Villejuif, Franța
3Universitatea din Paris Sud XI, Kremlin-Bicêtre, Franța
Institutul Național de Recuperare a Agronomiei (INRA), Micalis-UMR1319, 78360 Jouy-en-Josas, Franța
5Universitatea din Lille, CNRS, INSERM, Centrul Spitalicesc al Universității Regale din Lille, Institutul Pasteur de Lille, U1019, UMR 8204, Centrul de Infectare și Imunitate din Lille (CIIL), F-59000 Lille, Franța
6Centrul cercetărilor clinice în bioterapia cancerului 1428, Villejuif, Franța
7Université Paris Descartes, Sorbona Paris Cité, Paris, Franța
8Departamentul Oncologiei Radiației, Universitatea din New York, New York, NY, SUA
Unitatea de micropentru și imunitate, Institut Pasteur, Paris, Franța
10Singapore Immunology Network (SIgN), Agenția pentru Știință, Tehnologie și Cercetare (A * STAR), Singapore, Singapore
11Departament de Genetică și Departamentul de Medicină, Colegiul de Medicină Albert Einstein, Bronx, NY 10461, SUA
Platforma de metabolizare, GRCC, Villejuif, Franța
13Animale Centrale, Institutul Pasteur, Paris, Franța
14 Centrul Național de Cercetări Științifice, Institutul de Farmacologie și Biologie Structurale (IPBS), Toulouse, Franța
15 Universități din Toulouse, Université Paul Sabatier, IPBS, F-31077 Toulouse, Franța
16Departmentul Oncologiei Medicale, Institutul Gustave Roussy, Villejuif, Franța
17Service de microbiologie, GRCC, Villejuif, Franța
18Laborator de Imunomonitorizare în Oncologie, UMS 3655 CNRS / US 23 INSERM, GRCC, Villejuif, Franța
19INSERM U981, GRCC, Villejuif, Franța
20INSERM U848, Villejuif, Franța
21Echipa 11 Labellisée-Ligue Nationale contre Cancer, Centrul de Recherche des Cordeliers, INSERM U1138, Paris, Franța
22Pôle de Biologie, Höpital Européen Georges Pompidou, Asistență Publique-Hôpitaux de Paris, Paris, Franța
23 Unirea des Rickettsies, Facultate de Médecine, Université de la Méditerranée, Marsilia, Franța
24Institut Pasteur, unitatea de biologie și genetică a peretelui celular bacterian, Paris, Franța
25INSERM, Equipe Avenir, Paris, Franța
Departamentul de Gastroenterologie, Bichetul de Copii, Asistență Publique-Hôpitaux de Paris, Paris, Franța
†Autorul corespunzator. rf.yssuorevatsug@legovtiz.ecnerual
* Acești autori au contribuit în mod egal la această lucrare.
4. Commital Bifidobacterium promovează imunitatea antitumorală și facilitează eficacitatea imunoterapiei anti-PD-L1
Infiltrarea celulelor T a tumorilor solide este asociată cu rezultate favorabile ale pacienților, totuși mecanismele care stau la baza răspunsurilor imune variabile între indivizi nu sunt bine înțelese. Un posibil modulator ar putea fi microbiota intestinală. Am comparat creșterea melanomului la șoareci cu microbiologie comensă distinctă și s-au observat diferențe în imunitatea antitumorală spontană, care au fost eliminate la coagulare sau după transferul fecal.
Sequencing-ul ARN ribozomal 16S a identificat Bifidobacterium ca fiind asociat cu efectele antitumorale. Administrarea orală a Bifidobacterium singur a îmbunătățit controlul tumorii în același grad cu terapia cu anticorpi specifici pentru proteina 1 a ligandului 1 (PD-L1) (blocarea punctului de control) și tratamentul combinat aproape a abolit creșterea tumorală.
Funcția celulelor dendritice augmentate care conduce la îmbunătățirea primării și acumulării celulelor T CD8 + în micro-mediul tumoral a mediat efectul.
Datele noastre sugerează că manipularea microbiotei poate modula imunoterapia cancerului.
Ayelet Sivan, 1, * Leticia Corrales, 1, * Nathaniel Hubert, 2 Jason B. Williams, 1 Keston Aquino-Michaels, 3 Zachary M. Earley, 2 Franco W. Benyamin, 1 Yuk Man Lei, 2 Bana Jabri, 2 Maria -Luisa Alegre, 2 Eugene B. Chang, 2 și Thomas F. Gajewski1,2, †
1Department of Patology, Universitatea Chicago, Chicago, IL 60637, SUA
2Department of Medicine, Universitatea Chicago, Chicago, IL 60637, SUA
3Secția de Medicină Genetică, Universitatea din Chicago, Chicago, IL 60637, SUA
† Autor corespondent: ude.ogacihcu.dsb.enicidem@kswejagt
* Acești autori au contribuit în mod egal la această lucrare.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4873287/
http://science.sciencemag.org/content/early/2015/11/04/science.aac4255.full
5.Microbiota intestinala moduleaza Effectele imune anticanerigene ale Cyclophosphamide
Microbiota intestinala face o terapie anticancer bună
Microbiota intestinală a fost implicată în dezvoltarea unor cancere, cum ar fi cancerul colorectal, dar având în vedere rolul important pe care locuitorii noștri intestinali/bacteriile îl joacă în metabolism, pot modula și eficacitatea anumitor terapii anticanceroase. Iida și colab. (p. 967) a evaluat impactul microbiotei intestinale asupra eficacității unei imunoterapii [oligonucleotide CpG (legătura citozină, guanozină, fosfodiester)] și oxaliplatină, un compus platină utilizat ca chimioterapie.
Ambele terapii anticanceroase au fost reduse în eficacitate la șoarecii purtători de tumori care nu aveau microbiotă, microbiota fiind importantă pentru activarea răspunsului imun innascut împotriva tumorilor. Viaud și colab. (p. 971) a găsit un efect similar al microbiotei asupra șoarecilor purtători de tumori tratați cu ciclofosfamidă, dar în acest caz a apărut că microbiota a promovat un răspuns imun adaptiv împotriva tumorilor.
Abstract
Ciclofosfamida este unul dintre medicamentele de cancer importante din punct de vedere clinic, a căror eficacitate terapeutică se datorează în parte capacității lor de a stimula răspunsurile imune antitumorale. Studiind modele de șoarece, demonstrăm că ciclofosfamida modifică compoziția microbiotei din intestinul subțire și induce translocarea speciilor selectate de bacterii Gram-pozitive în organele limfoide secundare. Acolo, aceste bacterii stimulează generarea unui subset specific al celulelor „patogene” T helper 17 (pTH17) și a răspunsurilor imune TH1 ale memoriei. Șoarecii purtători de tumoare care au fost fără germeni/fara flora intestinala sau care au fost tratați cu antibiotice pentru a ucide bacterii gram pozitive au arătat o reducere a răspunsurilor pTH17, iar tumorile lor au fost rezistente la ciclofosfamidă. Transferul adoptiv al celulelor pTH17 a redus parțial eficacitatea antitumorală a ciclofosfamidei. Aceste rezultate sugerează că microbiota intestinală contribuie la formarea răspunsului imunitar anticanceros.
legatura alimentatie, microbiota
https://www.sciencedaily.com/releases/2014/08/140815192240.htm#.VlpvzsXD3Yk.email
legatura alimentatie, microbiota,cancer san
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3800670/
legatura microbiota si alimentatie bogata in grasimi
https://www.sciencedaily.com/releases/2015/08/150827130139.htm
si tot fiind noapte, nici de somn si melatonina(daca ati trecut de 30 ani , pina la 50 mg seara)
Noapte buna! Doamne ajuta!
Toate articolele sunt extraordinare. Nu doar prin cantitatea de informație (care și singură le conferă o valoare excepțională), ci și prin dragostea, bunătatea, bândețea, compasiunea care răzbat de sub rândurile articolelor științifice.
Doamne ajuta, Maria! Multumesc
Vitamina B12 nu trebuie evitată complet, ci numai păstrată justa măsură?
vedeti aici c cu b12 https://tratamenteanticancer.wordpress.com/2014/02/17/micsorarea-tumorilor/
Multumesc mult pt.tot ce pot citi datorita postarilor tale,imi pare tare rau ca nu am avut ocazia sa citesc(deci sa ma informez) inainte de a lua niste decizii,dar acum,asta e,sa-ti dea Dumnezeu multa sanatate.
mergem cu Dumnezeu inainte.Doamne ajuta!
Pingback: Un caz de remisie moleculară completă și durabilă a leucemiei limfocitare cronice în urma tratamentului cu EGCG epigalocatechin-3-galat, un extract de ceai verde | TRATAMENTE CANCER EFICIENTE, NON - toxice