- Diwakar Davar , Fei Ding , Melissa Saul , Cindy Sander , Ahmad A. Tarhini , John M. Kirkwood și Hussein A. Tawbi
Jurnal pentru Imunoterapie a Cancerului volum 5 , Număr articol: 74 ( 2017 ) Citați acest articol
Abstract
fundal
Remisii durabile sunt observate la o parte dintre pacienții cu melanom metastatic tratați cu interleukin-2 în doză mare (HD IL-2). Studiile timpurii au raportat rate de răspuns global (OR) și complet (CR) de 16% și, respectiv, 8%. Toxicitatea a limitat utilizarea centrelor specializate cu protocoale standardizate. Raportăm despre 243 de pacienți tratați la Universitatea din Pittsburgh într-un cadru de specialitate oncologie non-intensive unit (ICU).
Metode
Au fost colectate date clinice și radiologice pe 243 de pacienți tratați între 1992 și 2015. Fiecare ciclu HD IL-2 a fost administrat pe parcursul a 5 zile, ciclurile au fost repetate după 9 zile și cursurile (2 cicluri) au fost repetate la fiecare 6-9 săptămâni la pacienții cu stabilă. sau boală care răspunde, pentru până la 3 cure în total. Influența caracteristicilor de referință asupra rezultatelor a fost evaluată folosind estimările Kaplan-Meier și analiza riscurilor proporționale Cox.
Rezultate
Două sute patruzeci și trei de pacienți au primit 692 de cicluri (5270 doze) între 1992 și 2015. Două sute treizeci și șapte de pacienți au fost evaluați pentru răspuns: OR rata de 18,1% cu rata CR de 8,0%. Supraviețuirea globală mediană (SG) 9,6 luni în întreaga cohortă, dar 64,9 luni la respondenți. Numărul mediu de cicluri administrate a fost de 2, iar numărul mediu de doze pe ciclu a fost de 8. Toxicitatea a fost în concordanță cu rapoartele anterioare. HD IL-2 a necesitat transferuri de UTI la 11 pacienți și 1 deces a fost atribuit HD IL-2. Nivelurile de lactat dehidrogenază (LDH) pre-tratament au corelat semnificativ cu supraviețuirea fără progresie [1-2× limita superioară normală (ULN) HR 1,95; >2× LSN HR 2,32] și supraviețuirea globală (1-2× LSN HR 1,67; >2× LSN 2,49). Răspunsul la HD IL-2 și locul bolii metastatice s-au corelat, de asemenea, semnificativ cu supraviețuirea fără progresie și supraviețuirea globală.
Concluzii
În această serie mare de pacienți care se întinde pe mai mult de două decenii, ratele OR/CR cu HD IL-2 au fost de 18,1%/8,0%, respectiv. Datele de toxicitate au fost în concordanță cu rapoartele anterioare. Valorile LDH pre-tratament și locul (locurile) bolii metastatice pot fi markeri utili pentru selectarea pacienților cu o probabilitate mai mare de a beneficia de terapia HD IL-2.
fundal
Interleukina-2 este un factor de creștere a celulelor T cu efecte bine caracterizate asupra creșterii și expansiunii subgrupurilor de celule T, în special a celulelor T CD8+ și eficacitatea antitumorală documentată în cancerul renal avansat și melanom [1 , 2 ] . Melanomul avansat este o boală considerată anterior incurabilă, cu opțiuni de tratament limitate și cu o supraviețuire globală (SG) mediană estimată istoric la 8 până la 10 luni. Până acum, interleukina-2 în doză mare (HD IL-2) a fost singura imunoterapie aprobată pentru melanomul stadiul IV – bazată pe supraviețuirea durabilă pe termen lung observată la o fracțiune de pacienți raportați inițial într-un studiu de fază II în 1994, actualizat în continuare în o meta-analiză a studiilor de fază II publicată în 1999 [ 3 , 4 ]. În ultimul studiu, autorii au raportat 17 răspunsuri complete (6,3%) și 26 de răspunsuri parțiale (9,6%) pentru o rată de răspuns obiectiv (OR) de 15,9% la 270 de pacienți tratați. 12 din cei 43 de respondenți inițiali (27,9%, dintre care 10 au răspuns complet) au rămas fără progresie la momentul raportării, cu un platou în OS după 36 de luni. Cea mai frecventă toxicitate asociată cu HD IL-2 este hipotensiunea arterială, secundară scurgerii capilare subiacente, rezistență vasculară periferică redusă și debit cardiac crescut similar cu un sindrom de răspuns inflamator sistemic (SIRS) care reflectă mecanismul de acțiune al IL-2. Acest lucru, împreună cu utilizarea de rutină a vasopresoarelor pentru a maximiza intensitatea dozei, a contribuit la o incidență ridicată a toxicităților de gradul 3/4 și la terapia obligatorie într-un cadru foarte reglementat, de obicei o unitate de terapie intensivă (UTI).
Deceniul precedent a fost martor la progrese fără precedent în înțelegerea noastră atât a factorilor moleculari ai tumorigenezei melanomului, cât și a mecanismelor prin care tumorile deturnează punctele de control negative de reglementare pentru a evita imunitatea antitumorală; conducând la dezvoltarea de inhibitori țintiți ai căii de transducție a semnalului protein kinazei activate cu mitogen (MAPK) și puncte de control imunitare regulatoare negative. Șapte agenți noi, inclusiv inhibitori BRAF (vemurafenib și dabrafenib), inhibitor MEK (trametinib și cobimetinib), inhibitor antigen 4 al limfocitelor T anti-citotoxice (CTLA-4) ipilimumab, inhibitori ai morții programate 1 (PD-1) (nivolumab și pembrolizumab) și talimogene laherparepvec au demonstrat o supraviețuire îmbunătățită și sunt aprobate individual și în combinație pentru gestionarea melanomului avansat [ 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 ]. După aprobarea inhibitorilor BRAF/MEK și a anticorpilor de blocare a PD-1/CTLA-4 începând din 2011, utilizarea IL-2 HD în terapia de primă linie a melanomului a scăzut treptat.
Se știe puțin despre modul cel mai bun de secvențiere a acestor agenți, deși rapoarte limitate sugerează că pacienții care progresează peste HD IL-2 pot fi salvați cu inhibitori CTLA-4 și/sau PD-1, deși aceste numere sunt mici. La Institutul de Cancer al Universității din Pittsburgh, am implementat un protocol pentru administrarea HD IL-2 într-un cadru de specialitate oncologie non-UTI în 1994. Pentru a oferi estimări ale toxicității și eficacității acestei metode de administrare, am efectuat o analiză retrospectivă. a datelor de răspuns, supraviețuire și toxicitate a 243 de pacienți cu melanom avansat tratați cu HD IL-2 între 1992 și 2015.
Metode
Selectarea pacientului
Aprobarea a fost obținută de la Consiliul de revizuire instituțional (IRB) de la Universitatea din Pittsburgh Cancer Institute (UPCI) pentru o analiză retrospectivă a pacienților cu melanom avansat care au primit tratament cu HD IL-2 (număr IRB PRO13050140). Pacienții tratați între martie 1992 și iunie 2015 au fost incluși în această analiză. Pacienții au primit HD IL-2 fie ca terapie standard de îngrijire (SOC) (193 de pacienți), fie în cadrul unuia dintre cele două studii: UPCI 03–137 (HD IL-2 cu temozolomidă secvențială – 30 de pacienți) [ 15 , 16 ] și UPCI 10–095/NCI 8628 (HD IL-2 cu sau fără ziv-aflibercept – 60 de pacienți). Din cei 60 de pacienți tratați în UPCI 10–095/NCI 8628, 20 de pacienți tratați numai cu HD IL-2 au fost incluși, în timp ce cei 40 de pacienți tratați cu HD IL-2/ziv-aflibercept au fost excluși din această analiză. Rapoarte detaliate ale acestor studii au fost publicate anterior.
Administrarea medicamentelor
În toate cazurile (studiile SOC și UPCI 03–137/10–095), HD IL-2 a fost dozată la 600.000 UI/kg administrată prin perfuzie intravenoasă timp de 15 minute la fiecare 8 ore timp de până la 14 doze consecutive timp de 5 zile. Comenzile care detaliază fluidele de întreținere, antibioticele profilactice și monitorizarea de laborator au fost elaborate și introduse la internare pentru toți pacienții (disponibile la cerere). Ghidurile publicate au fost folosite pentru a ghida administrarea sau reținerea fiecărei doze [ 17 ]. Utilizarea în doză mică de dopamină (până la 5 μg/kg/min) a fost permisă pentru a menține producția de urină, deși vasopresoarele și/sau suportul ventilator nu au fost utilizate pentru a maximiza intensitatea dozei. Terapia a fost susținută pentru toxicitățile care limitează doza (DLT) relative și absolute acceptate în mod obișnuit; și s-a încheiat la cererea pacienților, dacă s-au reținut ≥3 doze pentru DLT relativ, sau la dezvoltarea a 1 sau mai multe DLT absolute [ 17 ]. DLT-urile primare care au condus la oprirea terapiei au fost înregistrate și tabulate.
Caracteristicile pacientului și clinice și detalii de dozare
În această analiză retrospectivă, statisticile descriptive (inclusiv mediane și interval) au fost utilizate pentru a rezuma variabilele demografice, de laborator și histopatologice. Sediul primar a fost clasificat ca cutanat, mucoasa, uveal sau necunoscut atunci cand pacientii prezentau boala metastatica in absenta unei leziuni primare clare. Amploarea bolii metastatice a fost stadializată conform sistemului de stadializare AJCC 2009 pentru M1a (metastaze cutanate, subcutanate și ganglionare) și M1b (metastaze pulmonare), dar am împărțit în continuare M1c (metastaze viscerale) pe baza prezenței absenței sistemului nervos central ( boala SNC) (M1c non-CNS și M1c SNC) [ 18 ]. Valorile lactat dehidrogenazei (LDH) pre-tratament au fost extrase și tricotomizate în normal, 1-2 × limita superioară normală (ULN) și >2 × ULN. Detalii privind numărul și natura terapiilor cu IL-2 pre-HD și terapiile cu IL-2 post-HD au fost obținute și tabulate. Înregistrările farmaciei au fost revizuite pentru detalii despre dozare și motivul (motivele) întreruperii terapiei.
Evaluarea toxicității, evaluarea răspunsului, determinarea supraviețuirii/progresiei și analize statistice
Evaluările de toxicitate au fost clasificate conform criteriilor comune de terminologie pentru evenimentele adverse ale Institutului Național al Cancerului, versiunea 3.0. DLT(ele) care au condus la încetarea terapiei au fost extrase din dosarul electronic de sănătate. Răspunsul la boală a fost determinat utilizând liniile directoare Response Evaluation Criteria in Solid Tumors (RECIST v1.1) [ 19 ]. Supraviețuirea fără progresie (PFS) a fost definită ca timp de la începutul terapiei cu IL-2 HD până la progresia radiografică, progresia clinică sau decesul, oricare dintre acestea a avut loc mai întâi. Acolo unde a fost posibil, progresia a fost caracterizată ca numai sistemică, numai SNC sau sistemică și SNC. OS a fost definit ca timpul de la inițierea HD IL-2 până la moarte. Influența caracteristicilor demografice și tumorale ale pacientului de bază asupra rezultatelor tratamentului a fost evaluată folosind analiza riscurilor proporționale Cox. Metodele Kaplan-Meier au fost utilizate pentru a genera estimări pentru PFS și OS împreună cu intervalele de încredere (CI) de 95%. Limita de date a fost definită la 30.1.2017. Toate analizele statistice au fost efectuate post-hoc și nu au fost ajustate pentru teste multiple.
Rezultate
Pacienți și caracteristici clinice
Între martie 1992 și iunie 2015, au fost agregate date de la 243 de pacienți cu melanom în stadiul IV al Comitetului mixt american pentru cancer (AJCC) care au primit cel puțin 1 ciclu de IL-2 HD. Caracteristicile inițiale ale tuturor celor 243 de pacienți sunt detaliate în Tabelul 1 . 55% dintre pacienți erau bărbați, cu o vârstă medie de 48 de ani. 77% (188/243) dintre pacienții tratați au avut melanom cutanat, în timp ce o minoritate de pacienți au avut mucoase (6%, 14/243), uveale (7%, 16/243) sau primare necunoscute (10%, 24/243). 18% dintre pacienți au avut o boală metastatică limitată la piele, țesut subcutanat și/sau ganglioni limfatici (M1a), în timp ce 24% dintre pacienți au avut metastaze pulmonare (M1b) și 18% au tratat metastaze ale sistemului nervos central (SNC). Restul de 40% au avut metastaze viscerale non-pulmonare. La momentul limitării datelor, durata mediană a urmăririi a fost de 9,4 luni (interval de la 0,2 la 273 de luni).Tabelul 1 Caracteristici inițiale
Profilul de toxicitate
Două sute patruzeci și trei de pacienți au primit 5270 de doze de HD IL-2 pe parcursul a 692 de cicluri în total. Numărul de pacienți care au continuat să primească HD IL-2 a scăzut cu cicluri succesive – fie pentru progresie, fie pentru toxicitate. Per pacient, numărul median de cicluri primite a fost de 2, numărul median de doze totale primite a fost de 17 și numărul median de doze pe ciclu primite a fost de 8. Administrarea de IL-2 HD a dus la 11 internari la unitatea de terapie intensivă (ICU) (12/692). cicluri, 1,6% incidență) cel mai frecvent pentru hipotensiune arterială care nu răspunde la resuscitarea cu lichide care necesită administrare de vasopresoare și hipoxemie secundară sindromului de scurgere capilară pulmonară. 1 deces a fost atribuit HD IL-2 (mortalitate 0,4%). S-a obținut incidența DLT-urilor relative și/sau absolute care au condus la încetarea terapiei cu HD IL-2 și sunt tabulate în fișierul suplimentar 1 : Tabelul S1. Profilul de toxicitate a fost în concordanță cu rapoartele anterioare ale acestui agent. În toate ciclurile, oliguria (14%-58%), hipotensiunea (14%-39%) și tahicardia (10%-21%) au reprezentat majoritatea DLT-urilor relative/absolute.
Analiza răspunsului.
Din 243 de pacienți tratați, 237 de pacienți au fost evaluați pentru răspuns (rezumat în Tabelul 2 ). Șase pacienți nu au fost evaluați pentru răspuns. Răspunsurile complete (CR) au fost observate în 19 (8%), în timp ce răspunsurile parțiale (PR) au fost observate în 24 (10%) pentru o rată globală de răspuns (ORR) de 18% (95% CI 13%–24%). În plus, 54 de pacienți (23%) au avut boală stabilă pentru o rată de control al bolii (DCR) de 41% (95% CI 35%-47%). Răspunsul nu a diferit semnificativ în funcție de locul tumorii primare, deși numărul de primari non-cutanate uveale/mucoase a fost scăzut în această serie (a se vedea fișierul suplimentar 1 : Tabelul S2). Din cei 19 pacienți care au avut un CR la HD IL-2; Ulterior, 3 pacienți au recidivat, dintre care 1 a decedat după dezvoltarea bolii SNC. Un al doilea pacient a dezvoltat o recidivă subcutanată izolată, dovedită prin biopsie, care a fost rezecata și iradiată și rămâne liberă de boală; în timp ce al 3-lea pacient a obținut o remisiune durabilă cu terapia cu inhibitor PD-1 de linia a patra cu pembrolizumab după progresia pe vemurafenib/inhibitorul PI3K PX-866 și ipilimumab cu inhibitor CTLA-4 după progresia pe HD IL-2 inițială.Tabelul 2 Răspunsul tumorii la HD IL-2
Am observat că numărul mediu de doze administrate diferă în funcție de categoria de răspuns. Deloc surprinzător, pacienții cu răspunsuri complete/parțiale au primit doze mai mari semnificative statistic (mediană = 33), decât pacienții cu boală stabilă sau non-răspunzători (mediană = 16) ( p < 0,0001).
Starea mutațiilor BRAF și NRAS a fost cunoscută la 51 și, respectiv, la 37 de pacienți. ORR a fost de 31% (95% CI 15%-51%) la BRAF mutant, comparativ cu 14% (3%-35%) la pacienții de tip sălbatic BRAF . Deși această diferență nu a fost semnificativă statistic, este în concordanță cu datele anterioare care sugerează rate de răspuns mai mari la pacienții mutanți BRAF/NRAS comparativ cu pacienții de tip sălbatic [ 20 ]. Având în vedere numărul mic de pacienți mutanți NRAS , statisticile de răspuns diferențial între pacienții mutanți NRAS și pacienții de tip sălbatic nu pot fi interpretate. Deși rata de răspuns a fost mai mare în prima linie (23%) decât în a doua linie sau următoarea (14%), această diferență nu a fost semnificativă statistic.
Analize PFS și OS
Analiza primară a 243 de pacienți a evidențiat un OS median de 9,6 luni (IC 95%, 7,4 până la 11,2 luni) în întreaga cohortă, dar 64,9 luni (IC 95%, 28,2-infinit) la respondenți. Ratele de supraviețuire la 1, 2 și 3 ani au fost de 41%, 20% și, respectiv, 14%. Mediana PFS a fost de 2,8 luni (95% CI 2,2–3,5) după excluderea a 6 pacienți considerați neevaluați pentru progresie. Durata mediană de urmărire a fost de aproximativ 9,4 luni (interval 0,2 până la 273 luni) la momentul limitării datelor. Analiza primară a inclus 19 respondenți completi cu un timp median de urmărire de 88,9 luni (interval de la 3,6 la 273 de luni). Dintre aceștia, 3 pacienți au progresat, dintre care 2 au fost ulterior salvați ca mai sus. Doi pacienți cu CR au murit – deși doar un deces a fost legat de recurența melanomului.
În compararea ratelor de răspuns de 1-/2-/3 ani pentru respondenți și non-respondenți, am luat în considerare două categorii de respondenți: prima excluzând pacienții cu boală stabilă (numai CR/PR) și a doua incluzând pacienții cu boală stabilă (CR/PR). /SD). Ratele OS la 1-/2-/3-an pentru pacienții CR/PR au fost de 95%/73%/63%; în timp ce ratele PFS de 1-/2-/3 ani pentru pacienții CR/PR au fost de 69%/52%/42% respectiv. Când pacienții cu boală stabilă au fost incluși ca respondenți, ratele OS la 1-/2-/3 ani pentru pacienții CR/PR/SD au fost de 71%/41%/31%; în timp ce ratele PFS de 1-/2-/3 ani pentru pacienții CR/PR/SD au fost de 35%/23%/19% respectiv. Curbele Kaplan-Meier pentru PFS și OS prin răspuns sunt prezentate în Fig. 1 . Factorii potențial de prognostic sunt delimitați în detaliu în fișierul suplimentar 1 : Tabelele S3 și S4.
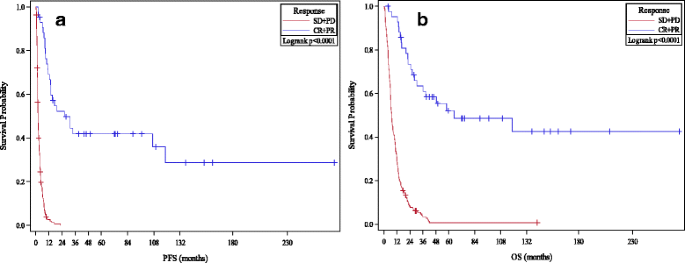
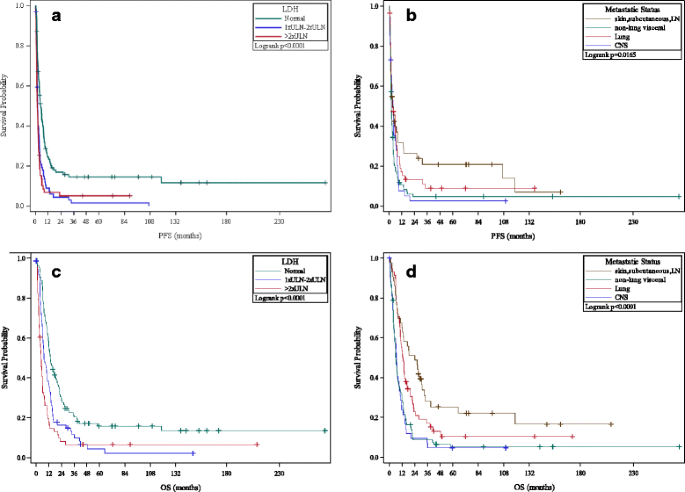
Atât creșterea absolută a LDH, cât și amploarea creșterii LDH au fost corelate cu o SSP mai proastă în comparație cu pacienții cu LDH normală: 1-2 × ULN (HR 1,95, 95% CI 1,41 până la 2,69) și >2 × ULN (HR 2,32, 95% CI). 1,66 până la 3,26). În comparație cu pacienții cu boală M1a, pacienții cu boală M1c non-SNC (HR 1,77, 95% CI 1,19-2,64) și boala M1c SNC (HR 1,54, 95% CI 0,97-2,45) au avut SSP mai rău. Tendințe similare în legătură cu OS au fost observate pentru locul metastatic pre-tratament și gradul de creștere a LDH (vezi Fig. 2 ).
Eficacitatea terapiilor post-HD IL-2
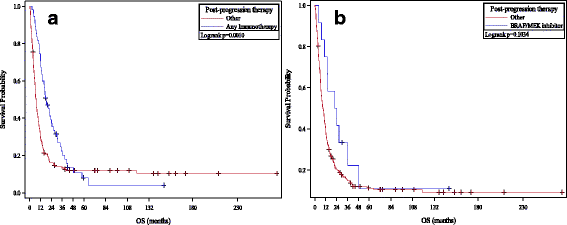
Amploarea progresiei (sistemică vs. SNC vs. sistemică și SNC) a fost cunoscută la 189 (78%) pacienți. Nu a existat nicio diferență semnificativă între pacienții care au progresat cu metastaze la SNC și cei care au progresat sistemic ( p = 0,056 pentru OS, 0,97 pentru PFS). Informațiile despre terapiile post-progresie au fost disponibile pe 210 (86%) pacienți (vezi Fig. 3 ). Treizeci și șase de pacienți au fost tratați cu inhibitori CTLA-4 și/sau PD-1, în timp ce 12 pacienți au fost tratați cu inhibitori BRAF sau BRAF/MEK. Din cei 36 de pacienți tratați cu inhibitori ai CTLA-4 sau PD-1, 7 (19%) pacienți rămân în viață cu un răspuns continuu la blocarea CTLA-4 sau PD-1, similar datelor publicate anterior privind beneficiul clinic al ipilimumabului și pembrolizumabului în HD. Progresori IL-2 [ 21 ]. Ratele de supraviețuire ale pacienților care au primit tratament cu inhibitor al punctului de control CTLA-4/PD-1 după progresia pe HD IL-2 (rate de supraviețuire la 1-/2-/3 ani de 78%/55%/32%) au fost similare cu cele publicat pentru acești agenți în mod independent, sugerând că eșecul cu HD IL-2 nu împiedică răspunsul la acești agenți [ 22 , 23 , 24 ]. Printre cei 12 pacienți cu melanom mutant BRAF care au primit inhibitori BRAF/MEK, durata medie a terapiei a fost de 8,0 luni – sugerând că aceste terapii își păstrează eficacitatea la pacienții care progresează pe HD IL-2.
Incidența și eficacitatea HD IL-2 în melanomul metastatic al SNC
Datele referitoare la dezvoltarea și gestionarea metastazelor SNC au fost disponibile pe 240 de pacienți la care incidența metastazelor SNC a fost de 38% (vezi fișierul suplimentar 1 : Tabelul S5). Nu a existat nicio diferență substanțială în PFS între pacienții care au avut (SSP mediană 3,0, 95% CI 2,1–3,7) și cei care nu (SLP mediană 2,6, 95% CI 1,9-3,7) dezvoltă metastaze la SNC (p = 0,056 ) . O mică parte a pacienților cu metastaze la SNC tratate au avut PFS durabilă pe termen lung, deși nu s-au observat diferențe semnificative între pacienții care au dezvoltat metastaze la SNC înainte sau după terapia HD IL-2 (p = 0,41 ) .
Discuţie
Din cunoștințele noastre, această colecție de 243 de pacienți cu melanom tratați cu HD IL-2 este cea mai mare serie instituțională de până în prezent care corelează răspunsul cu PFS/OS care a cuprins epoca de dinainte și de după introducerea unor terapii eficiente care vizează mutațiile driverului (inhibitori BRAF/MEK). ) și puncte de control regulatoare negative (inhibitori CTLA-4/PD-1). Ratele OS au fost comparate între pacienții tratați înainte și după ce acești agenți au fost disponibili în studiile clinice la instituția-mamă (2006) și după aprobarea de reglementare (2010). Ratele OS au rămas neschimbate la pacienții tratați înainte de 2006 și după 2007. Cu toate acestea, în comparație cu pacienții tratați înainte de 2010, pacienții tratați după 2011 au avut OS îmbunătățit ( p = 0,0053), reflectând probabil disponibilitatea crescută a terapiilor foarte eficiente, cum ar fi CTLA-4/ Inhibitorii PD-1 și BRAF/MEK în comunitate. Alte două serii mari au studiat eficacitatea HD IL-2 la pacienții cu melanom și carcinom cu celule renale (RCC): Providence Cancer Center (314 pacienți cu melanom) [ 25 ] și un studiu mai recent PROCLAIM SM (170 pacienți cu melanom ) [ 26 ]. În mod interesant, ratele noastre de răspunsuri au fost similare cu cele din Alva și colab., raportate mai recent. studiu, ambele fiind mai mici decât cele raportate în studiul mai vechi Providence Cancer Center; diferențele posibil explicate prin intensitatea relativă a dozei, deduse din utilizarea presorului și factorii de selecție a pacienților inerenți studiului de studiu Providence Cancer Center, care a cuprins în principal pacienți tratați înainte de apariția terapiilor moderne.
În concordanță cu rapoartele anterioare de la Filiala Chirurgicală a NCI și alte serii mari, curbele OS din această analiză arată un platou clar care a început la aproximativ 36 de luni după inițierea terapiei [ 25 , 26 , 27 ]. Pacienții care au atins acest reper de supraviețuire – 14% în această analiză – par să aibă un risc scăzut de recidivă/deces ulterioară. Din păcate, în absența unei imagini de supraveghere continuă, este imposibil să se clarifice dacă acești pacienți sunt cu adevărat liberi de boală sau au tumori reziduale de nivel scăzut. OS mediană (10,5 luni față de 8,0 luni) și ratele de supraviețuire la 3 ani (15% și 13%) au fost similare pentru pacienții tratați în prima sau a doua linie/ulterioară. Cu toate acestea, analizele post-hoc nu țin cont de diferențele potențiale ale factorilor cheie de prognostic între grupuri, care împiedică tragerea de concluzii definitive cu privire la beneficiile relative ale utilizării HD IL-2 în prima linie sau setarea ulterioară.
Prezența LDH crescută și/sau metastaze viscerale/SNC înainte de HD IL-2 a fost asociată cu OS mai slab. Analizele tendințelor au sugerat că gradul de creștere a LDH părea să aibă un impact prognostic: pacienții cu valori >2x LDH LDH au avut PFS/OS semnificativ mai slabe decât pacienții cu 1-2x LDH LDH, care la rândul lor s-au descurcat mai rău decât pacienții cu LDH normale. În mod similar, pacienții cu metastaze M1c (CNS și non-SNC) au avut PFS/OS semnificativ mai slabă decât pacienții cu boala M1a și M1b. Deși prezența bolii SNC a fost corelată cu un rezultat advers, un subgrup de pacienți cu boală SNC tratată a avut remisiuni durabile pe termen lung, în concordanță cu rapoartele anterioare ale activității SNC a HD IL-2 [28 , 29 ] .
Diverse grupuri au evaluat utilitatea biomarkerilor predictivi pentru a prezice beneficiul HD IL-2 în RCC și melanom. Mai mulți factori, inclusiv povara bolii, modelul de creștere alveolară și boala indolentă sunt asociați cu rate crescute de răspuns la HD IL-2 în RCC, deși anhidraza carbonică IX pare a fi mai prognostică decât predictivă a răspunsului HD IL-2. Cu toate acestea, un studiu prospectiv de validare a biomarkerilor (HD IL-2 „SELECT”) bazat pe acest model de „selecție integrată” (ISM) a concluzionat că ratele de răspuns nu diferă semnificativ în funcție de clasificarea ISM [30 ] . Un clasificator similar bazat pe profilarea expresiei genelor la pacienții cu melanom tratați cu HD IL-2 a raportat anterior rate de răspuns mai mari în tumorile care exprimau anumite gene, inclusiv anexina A1, IL6R, oncostatina M, MCSF și GMCSF (clasa 2), comparativ cu tumorile care exprimau MITF și expresia antigenului melanocitar (clasa 1) [ 31 ]; a cărui validare prospectivă este în așteptare în acest moment. Având în vedere numărul mic de pacienți mutanți NRAS din seria noastră, nu am fost capabili să validăm în mod independent impactul său favorabil la pacienții tratați cu HD IL-2 [ 20 ].
Progresele fundamentale în imunologia tumorii au identificat punctele de control negative de reglementare (CTLA-4/PD-1) ca mediatori cheie ai evadării imune. Anticorpii blocanți la CTLA-4 (ipilimumab) și PD-1 (pembrolizumab și nivolumab) au raportat rate de supraviețuire durabilă de 20%–23% și, respectiv, 25%–30% la 3 ani [22 , 23 , 24 ] . Studiile de urmărire pe termen lung sugerează că răspunsurile sunt durabile, mai ales dacă sunt în curs de desfășurare în ultimele 36-48 de luni – similare cu cele observate cu HD IL-2 în această serie și în alte serii. HD IL-2 este eficientă la o mică proporție de pacienți care au progresat peste inhibitorii punctelor de control CTLA-4 sau PD-1/PD-L1 [32] – o abordare este evaluată prospectiv într -un studiu al Grupului de lucru Cytokine (NCT02796352).
În peisajul actual, ratele de răspuns superioare observate cu inhibitorii BRAF/MEK și inhibitorii PD-1/CTLA-4 au determinat ca acești agenți să înlocuiască HD IL-2 în tratamentul pacienților cu melanom; în special atunci când este cuplat cu complexitatea asociată administrării IL-2 HD. Cu toate acestea, identificarea biomarkerilor predictivi și/sau eficacitatea stabilită într-o cohortă refractară PD-1 poate duce la rămânerea IL-2 HD în armamentul terapeutic pentru melanom.
Separat, a fost dezvoltată o formă modificată de aldesleukină în care conjugarea cu 6 lanțuri de polietilen glicol (PEG) eliberabile are ca rezultat o porțiune (NKTR-214) care asigură o expunere semnificativă mai mare a tumorii cu o dozare mai puțin frecventă (în comparație cu aldesleukină) cu un interes in vitro. activitate individuală și în combinație cu blocarea punctelor de control imun [ 33 ]. Un studiu timpuriu de stabilire a dozei a raportat activitate cu un singur agent în RCC și melanom cu profil favorabil de siguranță și tolerabilitate, cuplat cu un program convenabil de administrare în ambulatoriu, deși aceste date nu au fost publicate [34 ] .
În concluzie, această analiză comună a pacienților cu melanom avansat tratați cu HD IL-2 în epoca modernă se adaugă la datele disponibile care indică supraviețuirea durabilă pe termen lung la respondenți. Mediana PFS/OS a fost de 2,8 luni, respectiv 9,6 luni. Curbele OS s-au stabilizat după 3 ani – asemănător cu modelul observat în analizele grupate ale pacienților cu melanom tratați cu inhibitor CTLA-4 ipilimumab și inhibitori PD-1 nivolumab și pembrolizumab, deși la o fracție mai mică [22 , 23 , 24 ] . Gradul de creștere a LDH și boala M1c prevestesc rezultate mai slabe de supraviețuire cu HD IL-2 și ar trebui luate în considerare în evaluarea studiilor în curs/viitoare ale acestui agent și, eventual, alți agenți imunoterapeutici, inclusiv inhibitori ai punctelor de control. Deși numărul este mic, fracția de respondenți la blocarea PD-1/CTLA-4 și durata răspunsului la inhibitorii BRAF (sau BRAF + MEK) după progresia pe HD IL-2 este în concordanță cu alte rapoarte.
Concluzii
Blocarea punctului de control imunitar a transformat gestionarea melanomului avansat cu răspunsuri durabile la până la 40% dintre pacienții tratați. Cu toate acestea, nu toți pacienții răspund și nu există biomarkeri predictivi validați. HD IL-2 rămâne un tratament viabil în melanom și poate fi administrat în siguranță într-un cadru non-UTI. Povara bolii înainte de tratament și creșterea LDH pot selecta pentru pacienții cu o probabilitate mai mare de a beneficia de IL-2 HD.
Abrevieri
AJCC:
Comitetul mixt american pentru cancerCI:
Intervale de încredereSNC:
Sistem nervos centralCR:
Răspuns completCTLA-4:
Antigenul citotoxic al limfocitelor T 4DLT:
Toxicități limitatoare de dozăHD IL-2:
Interleukină-2 în doză mareUTI:
Unitate de terapie intensivaIRB:
Consiliul Instituțional de RevizuireLDH:
Lactat dehidrogenazăSAU:
Răspuns generalOS:
Supraviețuirea generalăPD-1:
Moartea programată 1PFS:
Supraviețuire fără progresieRECIST:
Criterii de evaluare a răspunsului în tumorile solideSOC:
Standard de îngrijireULN:
Limita superioară normalăUPCI:
Institutul de Cancer al Universității din Pittsburgh
Referințe
- Lotze MT, Frana LW, Sharrow SO, Robb RJ, Rosenberg SA. Administrarea in vivo a interleukinei umane purificate 2. I. Timpul de înjumătățire și efectele imunologice ale interleukinei derivate din linia celulară Jurkat 2. J Immunol. 1985;134:157–66.CAS PubMed Google Academic
- Lotze MT, Matory YL, Ettinghausen SE, Rayner AA, Sharrow SO, Seipp CA, Custer MC, Rosenberg SA. Administrarea in vivo a interleukinei umane purificate 2. II. Timp de înjumătățire, efecte imunologice și expansiune a celulelor limfoide periferice in vivo cu IL 2 recombinant. J Immunol. 1985;135:2865–75.CAS PubMed Google Academic
- Atkins MB, Lotze MT, Dutcher JP, Fisher RI, Weiss G, Margolin K, Abrams J, Sznol M, Parkinson D, Hawkins M, Paradise C, Kunkel L, Rosenberg SA. Terapia cu interleukină 2 recombinată cu doze mari pentru pacienții cu melanom metastatic: analiza a 270 de pacienți tratați între 1985 și 1993. J Clin Oncol. 1999;17:2105–16.Articol CAS PubMed Google Academic
- Rosenberg SA, Yang JC, Topalian SL, Schwartzentruber DJ, Weber JS, Parkinson DR, Seipp CA, Einhorn JH, White DE. Tratamentul a 283 de pacienți consecutivi cu melanom metastatic sau cancer cu celule renale folosind interleukina 2 în bolus în doză mare. JAMA. 1994;271:907–13.Articol CAS PubMed Google Academic
- Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, Dummer R, Garbe C, Testori A, Maio M, Hogg D, Lorigan P, Lebbe C, Jouary T, Schadendorf D, Ribas A, O’ Day SJ, Sosman JA, Kirkwood JM, Eggermont AM, Dreno B, Nolop K, Li J, Nelson B, Hou J, Lee RJ, Flaherty KT, McArthur GA. Grupul de studiu BRIM-3: supraviețuire îmbunătățită cu vemurafenib în melanomul cu mutație BRAF V600E. N Engl J Med. 2011;364:2507–16.Articol CAS PubMed PubMed Central Google Academic
- Flaherty KT, Robert C, Hersey P, Nathan P, Garbe C, Milhem M, Demidov LV, Hassel JC, Rutkowski P, Mohr P, Dummer R, Trefzer U, Larkin JM, Utikal J, Dreno B, Nyakas M, Middleton MR , Becker JC, Casey M, Sherman LJ, Wu FS, Ouellet D, Martin AM, Patel K, Schadendorf D. Grup de studiu METRIC: supraviețuire îmbunătățită cu inhibarea MEK în melanomul cu mutație BRAF. N Engl J Med. 2012;367:107–14.Articol CAS PubMed Google Academic
- Flaherty KT, Infante JR, Daud A, Gonzalez R, Kefford RF, Sosman J, Hamid O, Schuchter L, Cebon J, Ibrahim N, Kudchadkar R, Burris HA, Falchook G, Algazi A, Lewis K, Long GV, Puzanov I , Lebowitz P, Singh A, Little S, Sun P, Allred A, Ouellet D, Kim KB, Patel K, Weber J. Inhibarea combinată a BRAF și MEK în melanom cu mutații BRAF V600. N Engl J Med. 2012;367:1694–703.Articol CAS PubMed PubMed Central Google Academic
- Long GV, Stroyakovskiy D, Gogas H, Levchenko E, de Braud F, Larkin J, Garbe C, Jouary T, Hauschild A, Grob JJ, Chiarion Sileni V, Lebbe C, Mandalà M, Millward M, Arance A, Bondarenko I, Haanen JB, Hansson J, Utikal J, Ferraresi V, Kovalenko N, Mohr P, Probachai V, Schadendorf D, Nathan P, Robert C, Ribas A, DeMarini DJ, Irani JG, Casey M, et al. Inhibarea BRAF și MEK combinată față de inhibarea BRAF singură în melanom. N Engl J Med. 2014;371:1877–88.Articol PubMed Google Academic
- Robert C, Karaszewska B, Schachter J, Rutkowski P, Mackiewicz A, Stroiakovski D, Lichinitser M, Dummer R, Grange F, Mortier L, Chiarion-Sileni V, Drucis K, Krajsova I, Hauschild A, Lorigan P, Wolter P, Long GV, Flaherty K, Nathan P, Ribas A, Martin AM, Sun P, Crist W, Legos J, Rubin SD, Little SM, Schadendorf D. Supraviețuirea globală îmbunătățită în melanom cu dabrafenib și trametinib combinate. N Engl J Med. 2015;372:30–9.Articol PubMed Google Academic
- Long GV, Stroyakovskiy D, Gogas H, Levchenko E, de Braud F, Larkin J, Garbe C, Jouary T, Hauschild A, Grob JJ, Chiarion-Sileni V, Lebbe C, Mandalà M, Millward M, Arance A, Bondarenko I , Haanen JB, Hansson J, Utikal J, Ferraresi V, Kovalenko N, Mohr P, Probachai V, Schadendorf D, Nathan P, Robert C, Ribas A, DJ DM, Irani JG, Swann S, et al. Dabrafenib și trametinib versus dabrafenib și placebo pentru melanomul mutant Val600 BRAF: un studiu controlat randomizat de fază 3, multicentric, dublu-orb. Lancet. 2015;386:444–51.Articol CAS PubMed Google Academic
- Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, Gonzalez R, Robert C, Schadendorf D, Hassel JC, Akerley W, van den Eertwegh AJ, Lutzky J, Lorigan P, Vaubel JM, Linette GP, Hogg D, Ottensmeier CH, Lebbé C, Peschel C, Quirt I, Clark JI, Wolchok JD, Weber JS, Tian J, Yellin MJ, Nichol GM, Hoos A, Urba WJ. Supraviețuirea îmbunătățită cu ipilimumab la pacienții cu melanom metastatic. N Engl J Med. 2010;363:711–23.Articol CAS PubMed PubMed Central Google Academic
- Ribas A, Puzanov I, Dummer R, Schadendorf D, Hamid O, Robert C, Hodi FS, Schachter J, Pavlick AC, Lewis KD, Cranmer LD, Blank CU, O’Day SJ, Ascierto PA, Salama AK, Margolin KA, Loquai C, Eigentler TK, Gangadhar TC, Carlino MS, Agarwala SS, Moschos SJ, Sosman JA, Goldinger SM, Shapira-Frommer R, Gonzalez R, Kirkwood JM, Wolchok JD, Eggermont A, Li XN și colab. Pembrolizumab versus chimioterapia la alegere de investigator pentru melanomul refractar la ipilimumab (KEYNOTE-002): un studiu randomizat, controlat, de fază 2. Lancet Oncol. 2015;16:908–18.Articol CAS PubMed Google Academic
- Weber JS, SP D’ A, Minor D, Hodi FS, Gutzmer R, Neyns B, Hoeller C, Khushalani NI, Miller WH, Lao CD, Linette GP, Thomas L, Lorigan P, Grossmann KF, Hassel JC, Maio M, Sznol M, Ascierto PA, Mohr P, Chmielowski B, Bryce A, Svane IM, Grob JJ, Krackhardt AM, Horak C, Lambert A, Yang AS, Larkin J. Nivolumab versus chimioterapia la pacienții cu melanom avansat care au progresat după anti-CTLA -4 tratament (CheckMate 037): un studiu randomizat, controlat, deschis, de fază 3. Lancet Oncol. 2015;16:375–84.Articol CAS PubMed Google Academic
- Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, Schadendorf D, Dummer R, Smylie M, Rutkowski P, Ferrucci PF, Hill A, Wagstaff J, Carlino MS, Haanen JB, Maio M, Marquez-Rodas I, McArthur GA, Ascierto PA, Long GV, Callahan MK, Postow MA, Grossmann K, Sznol M, Dreno B, Bastholt L, Yang A, Rollin LM, Horak C, Hodi FS și colab. Nivolumab combinat și ipilimumab sau monoterapie în melanomul netratat. N Engl J Med. 2015;373:23–34.Articol PubMed Google Academic
- Tarhini AA, Kirkwood JM, Gooding WE, Cai C, Agarwala SS. Răspunsuri complete durabile cu interleukină-2 în bolus în doză mare la pacienții cu melanom metastatic care au prezentat progresie după biochimioterapie. J Clin Oncol. 2007;25:3802–7.Articol CAS PubMed Google Academic
- Tarhini AA, Kirkwood JM, Gooding WE, Moschos S, Agarwala SS. Un studiu de fază 2 de chimioterapie secvenţială cu temozolomidă, urmată de imunoterapie cu doze mari de interleukină 2 pentru melanomul metastatic. Cancer. 2008;113:1632–40.Articol CAS PubMed Google Academic
- Schwartzentruber DJ. Linii directoare pentru administrarea în siguranță a interleukinei-2 în doze mari. J Imunalt. 2001;24:287–93.Articol CAS PubMed Google Academic
- Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, Buzaid AC, Cochran AJ, Coit DG, Ding S, Eggermont AM, Flaherty KT, Gimotty PA, Kirkwood JM, McMasters KM, Mihm MC, Morton DL , Ross MI, Sober AJ, Sondak VK. Versiunea finală a stadializării și clasificării melanomului AJCC din 2009. J Clin Oncol. 2009(27):6199–206.
- Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M, Rubinstein L, Shankar L, Dodd L, Kaplan R, Lacombe D, Verweij J. Răspuns nou criterii de evaluare în tumorile solide: ghidul RECIST revizuit (versiunea 1.1). Eur J Cancer. 2009;45:228–47.Articol CAS PubMed Google Academic
- Joseph RW, Sullivan RJ, Harrell R, Stemke-Hale K, Panka D, Manoukian G, Percy A, Bassett RL, Ng CS, Radvanyi L, Hwu P, Atkins MB, Davies MA. Corelarea mutațiilor NRAS cu răspunsul clinic la doze mari de IL-2 la pacienții cu melanom avansat. J Imunalt. 2012;35:66–72.Articol CAS PubMed PubMed Central Google Academic
- Joseph RW, Eckel-Passow JE, Sharma R, Liu P, Parker A, Jakob J, Buchbinder E, Bassett RL, Davies MA, Hwu P, Atkins MB, Sullivan RJ. Caracterizarea beneficiului clinic al ipilimumab la pacienții care au progresat la doze mari de IL-2. J Imunalt. 2012;35:711–5.Articol CAS PubMed Google Academic
- Schadendorf D, Hodi FS, Robert C, Weber JS, Margolin K, Hamid O, Patt D, Chen TT, Berman DM, Wolchok JD. Analiza grupată a datelor de supraviețuire pe termen lung din studiile de fază II și III cu Ipilimumab în melanomul nerezecabil sau metastatic. J Clin Oncol. 2015;33:1889–94.Articol CAS PubMed PubMed Central Google Academic
- Ribas A, Hamid O, Daud A, Hodi FS, Wolchok JD, Kefford R, Joshua AM, Patnaik A, Hwu WJ, Weber JS, Gangadhar TC, Hersey P, Dronca R, Joseph RW, Zarour H, Chmielowski B, Lawrence DP , Algazi A, Rizvi NA, Hoffner B, Mateus C, Gergich K, Lindia JA, Giannotti M, Li XN, Ebbinghaus S, Kang SP, Robert C. Association of pembrolizumab with tumor response and survival among patients with advanced melanom. JAMA. 2016;315:1600–9.Articol CAS PubMed Google Academic
- Larkin J, Lao CD, Urba WJ, McDermott DF, Horak C, Jiang J, Wolchok JD. Eficacitatea și siguranța Nivolumab la pacienții cu mutant BRAF V600 și melanom avansat BRAF de tip sălbatic: o analiză comună a 4 studii clinice. JAMA Oncol. 2015;1:433–40.Articol PubMed Google Academic
- Payne R, Glenn L, Hoen H, Richards B, Smith JW, Lufkin R, Crocenzi TS, Urba WJ, Curti BD. Răspunsuri durabile și toxicitate reversibilă a tratamentului cu doze mari de interleukină-2 al melanomului și cancerului renal într-un program de bioterapie din spitale comunitare. J Imunalt cancer. 2014;2:13.Articol PubMed PubMed Central Google Academic
- Alva A, Daniels GA, Wong MKK, Kaufman HL, Morse MA, McDermott DF, Clark JI, Agarwala SS, Miletello G, Logan TF, Hauke RJ, Curti B, Kirkwood JM, Gonzalez R, Amin A, Fishman M, Agarwal N , Lowder JN, Hua H, Aung S, Dutcher JP. Experiență contemporană cu terapia cu doze mari de interleukină-2 și impactul asupra supraviețuirii la pacienții cu melanom metastatic și carcinom renal metastatic. Cancer Immunol Immunother. 2016;65:1533–44.Articol CAS PubMed PubMed Central Google Academic
- Rosenberg SA. Ridicarea ștachetei: potențialul curativ al imunoterapiei umane împotriva cancerului. Sci Transl Med. 2012;4:127ps8.Articol PubMed Google Academic
- Powell S, Dudek AZ. Rezultatul unei singure instituții al terapiei cu doze mari de interleukin-2 (HD IL-2) pentru melanomul metastatic și analiza răspunsului favorabil în metastazele cerebrale. Anticancer Res. 2009;29:4189–93.CAS PubMed Google Academic
- Chu MB, Fesler MJ, Armbrecht ES, Fosko SW, Hsueh E, Richart JM. Terapia cu doze mari de interleukină-2 (HD IL-2) ar trebui luată în considerare pentru tratamentul pacienților cu metastaze cerebrale melanom. Chemother Res Pract. 2013;2013:726925.PubMed PubMed Central Google Academic
- DF MD, Cheng SC, Signoretti S, Margolin KA, Clark JI, Sosman JA, Dutcher JP, Logan TF, Curti BD, Ernstoff MS, Appleman L, Wong MK, Khushalani NI, Oleksowicz L, Vaishampayan UN, Mier JW, Panka DJ , Bhatt RS, Bailey AS, Leibovich BC, Kwon ED, Kabbinavar FF, Belldegrun AS, Figlin RA, Pantuck AJ, Regan MM, Atkins MB. Studiul „select” cu aldesleukin cu doze mari: un studiu pentru validarea prospectivă a modelelor predictive de răspuns la tratament la pacienții cu carcinom cu celule renale metastatic. Clin Cancer Res. 2015;21:561–8.Articol Google Academic
- Sullivan RJ, Hoshida Y, Brunet J, Tahan S, Alridge J, Kwabi C, Gardiner E, McDermott D, Golub T, Atkins MB. Un singur centru de experiență cu tratament cu IL-2 cu doze mari (HD) pentru pacienții cu melanom avansat și investigarea pilot a unei noi semnături de expresie genică ca predictor al răspunsului. Prezentat la: 2009 ASCO Annual Meeting; mai 2009. Rezumat 9003.
- Buchbinder EI, Gunturi A, Perritt J, Dutcher J, Aung S, Kaufman HL, Ernstoff MS, Miletello GP, Curti BD, Daniels GA, Patel SP, Kirkwood JM, Hallmeyer S, Clark JI, Gonzalez R, Richart JM, Lutzky J , Morse MA, Sullivan RJ, McDermott DF. O analiză retrospectivă a interleukinei-2 în doză mare (HD IL-2) după Ipilimumab în melanomul metastatic. J Imunalt cancer. 2016;4:52.Articol PubMed PubMed Central Google Academic
- Charych DH, Hoch U, Langowski JL, Lee SR, Addepalli MK, Kirk PB, Sheng D, Liu X, Sims PW, VanderVeen LA, Ali CF, Chang TK, Konakova M, Pena RL, Kanhere RS, Kirksey YM, Ji C , Wang Y, Huang J, Sweeney TD, Kantak SS, Doberstein SK. NKTR-214, o citokină proiectată cu legare părtinitoare a receptorului IL2, expunere crescută la tumoră și eficacitate marcată în modelele de tumori de șoarece. Clin Cancer Res. 2016;22:680–90.Articol CAS PubMed Google Academic
- Bernatchez C, Haymaker C, Tannir NM, et al. Un agonist părtinitor CD122 crește celulele CD8+T și celulele ucigașe naturale în micromediul tumoral; făcând tumorile reci fierbinți cu NKTR-214. Prezentat la: 2016 SITC Annual Meeting; 9–13 noiembrie 2016; National Harbour, MD. Rezumat 387.
Mulțumiri
Autorii sunt recunoscători „The Woiner Foundation” și „Annual 3-2-1 Ride” pentru sprijinul acordat.
Finanțarea
Această lucrare a fost susținută de Premiul P50 CA121973 de la Institutul Național al Cancerului (JMK).
Disponibilitatea datelor și materialelor
Seturile de date utilizate și/sau analizate în timpul studiului curent sunt disponibile de la autorul corespunzător, la cerere rezonabilă.
Informatia autorului
Autori și afilieri
- Institutul de Cancer al Universității din Pittsburgh și Centrul Medical al Universității din Pittsburgh, Pittsburgh, PA, SUADiwakar Davar și Cindy Sander
- Departamentul de Biostatistică, Universitatea din Pittsburgh și Centrul Medical al Universității din Pittsburgh, Pittsburgh, PA, SUAFei Ding
- Informatică de cercetare clinică, Universitatea din Pittsburgh și Centrul Medical al Universității din Pittsburgh, Pittsburgh, PA, SUAMelissa Saul
- Științe clinice și translaționale, Institutul de Cancer al Universității din Pittsburgh și Centrul Medical al Universității din Pittsburgh, Pittsburgh, PA, SUAAhmad A. Tarhini
- Dermatologie și științe clinice și translaționale, Institutul de Cancer al Universității din Pittsburgh și Centrul Medical al Universității din Pittsburgh, Pittsburgh, PA, SUAJohn M. Kirkwood
- Departamentul de Oncologie Medicală Melanom, Divizia de Medicină a Cancerului, Centrul de Cancer MD Anderson al Universității din Texas, Houston, TX, SUAHussein A. Tawbi
- Divizia de Hematologie-Oncologie, Universitatea din Pittsburgh Medical Center, 5117 Center Avenue, Pittsburgh, PA, 15232, SUADiwakar Davar
Contribuții
DD a conceput studiul; a participat la proiectarea și coordonarea studiului; date dobândite, analizate și interpretate; și a ajutat la redactarea manuscrisului. FD a efectuat analize statistice; date analizate și interpretate; și a ajutat la revizuirea manuscrisului. MS a ajutat la achiziționarea de date; și a ajutat la revizuirea manuscrisului. CS a ajutat la achiziționarea de date; și a ajutat la revizuirea manuscrisului. AAT a conceput studiul; și a ajutat la revizuirea manuscrisului. JMK a conceput studiul; și a ajutat la revizuirea manuscrisului. HAT conceput de studiu; a participat la proiectarea și coordonarea studiului; și a ajutat la redactarea manuscrisului. Toți autorii au citit și au aprobat manuscrisul final.
autorul corespunzator
Declarații de etică
Informațiile autorilor
Zero.
Diwakar Davar: Angajare (nul), Conducere (niciun), Acțiuni și alte interese de proprietate (niciun), Onorari (niciun), Rol de consultanță/consiliere (niciun), Biroul vorbitorilor (Incyte), Finanțare pentru cercetare (Merck & Co.; Incyte; Checkmate Pharmaceuticals).
Fei Ding: Angajare (nul), Conducere (niciun), Acțiuni și alte interese de proprietate (niciun), Onorari (nul), Rol de consultanță/consiliere (nul), Biroul vorbitorilor (nul), Finanțarea cercetării (nul).
Melissa Saul: Angajare (nulă), Conducere (nila), Acțiuni și alte interese de proprietate (nila), Onorari (nila), Rol de consultanță/consiliere (nila), Biroul vorbitorilor (nila), Finanțarea cercetării (nila).
Cindy Sander: Angajare (nulă), Conducere (nila), Acțiuni și alte interese de proprietate (nila), Onorari (nila), Rol de consultanță/consiliere (nila), Biroul vorbitorilor (nila), Finanțarea cercetării (nila).
Ahmad A Tarhini: Angajare (nul), Conducere (niciun), Acțiuni și alte interese de proprietate (niciun), Onorari (niciun), Rol de consultanță/consiliere (Bristol-Myers Squibb; Merck & Co.), Biroul de vorbitori (niciun) , Finanțarea cercetării (Amgen Inc.; Bristol-Myers Squibb; Merck & Co.; Novartis Pharmaceuticals Corporation).
John M. Kirkwood: Angajare (nulă), Conducere (nila), Acțiuni și alte interese de proprietate (nila), Onorari (nila), Rol de consultanță/consiliere (Bristol-Myers Squibb; Amgen Inc.; GreenPeptide; Roche; Genentech), Biroul Speakerilor (nul), Finanțarea cercetării (nul).
Hussein A Tawbi: Angajare (nulă), Conducere (nila), Acțiuni și alte interese de proprietate (nula), Onorari (nila), Rol de consultanță/consiliere (Novartis Pharmaceuticals Corporation), Biroul vorbitorilor (nila), Finanțarea cercetării (Bristol- Myers Squibb; Genentech, Inc.; Merck & Co.; Novartis Pharmaceuticals Corporation).
Aprobarea etică și acordul de participare
Aprobarea pentru colectarea, revizuirea și publicarea retrospectivă a datelor pentru pacienții cu melanom tratați cu HD IL-2 a fost obținută de la Consiliul Instituțional de Revizuire (IRB) al Institutului de Cancer din Pittsburgh (UPCI) (număr IRB PRO13050140). Pacienții tratați cu UPCI 03–137 și UPCI 10–095/NCI au primit acordul conform protocoalelor respective aprobate de IRB. Autorii atestă că tot consimțământul necesar a fost de la orice pacienți implicați în studiu.
Consimțământ pentru publicare
Nu se aplică.
Interese concurente
Autorii declară că nu au interese concurente.
Nota editorului
Springer Nature rămâne neutră în ceea ce privește revendicările jurisdicționale din hărțile publicate și afilierile instituționale.
Fișier suplimentar
Fișier suplimentar 1: Tabelul S1.
(Distribuția DLT a pacienților tratați cu HD IL-2); Tabelul S2. (Răspunsuri generale la terapia HD IL-2 la pacienții evaluabili în funcție de caracteristicile inițiale ( N = 237)); Tabelul S3. (Analize PFS după caracteristicile de bază); Tabelul S4. (Analize OS după caracteristicile de bază); și Tabelul S5. (Incidența metastazelor SNC ( N = 240)). (DOCX 57 kb)
Drepturi și permisiuni
Acces deschis Acest articol este distribuit în conformitate cu termenii licenței internaționale Creative Commons Attribution 4.0 ( http://creativecommons.org/licenses/by/4.0/ ), care permite utilizarea, distribuirea și reproducerea fără restricții în orice mediu, cu condiția să oferiți merită adecvată autorului(i) original(i) și sursei, furnizați un link către licența Creative Commons și indicați dacă s-au făcut modificări. Renunțarea la Creative Commons Public Domain Dedication ( http://creativecommons.org/publicdomain/zero/1.0/ ) se aplică datelor puse la dispoziție în acest articol, cu excepția cazului în care se specifică altfel.
Despre acest articol
Citează acest articol
Davar, D., Ding, F., Saul, M. şi colab. Doză mare de interleukină-2 (HD IL-2) pentru melanom avansat: o experiență cu un singur centru de la Institutul de Cancer al Universității din Pittsburgh. j. imunoterapie cancer 5 , 74 (2017). https://doi.org/10.1186/s40425-017-0279-5
- Primit07 iunie 2017
- Admis29 august 2017
- Publicat19 septembrie 2017
- DOIhttps://doi.org/10.1186/s40425-017-0279-5