Laura Campanacci1,Luca Cevolani1,*,Francesca De Terlizzi2,Laura Saenz3,Nikolin Ali1,Giuseppe Bianchi1și
1Unitatea a 3-a Clinică Ortopedică și Traumatologică Prevalent Oncologic, IRCCS Istituto Ortopedico Rizzoli, Via Pupilli 1, 40136 Bologna, Italia
2IGEA Clinical Biophysics, Via Parmenide 10/A, 41012 Carpi, Italia
3Departamentul de ortopedie, Spitalul Național de Copii, Calle 20 Av 0, San José 10103, Costa Rica
*Autorul căruia trebuie adresată corespondența.
Curr. Oncol. 2022 ,
29 (3), 1672-1682;
https://doi.org/10.3390/curroncol29030139
Dosare primită: 18 ianuarie 2022 /
Revizuit: 22 februarie 2022 /
Acceptat: 3 martie 2022 /
Publicat: 4 martie 2022(Acest articol aparține Tratamentului special
Examinare rapoarte Note versiuni
Abstract
Metastazele osoase induc durere, risc de fractură și compresie neuronală, precum și mobilitate redusă și calitatea vieții. Electrochimioterapia (ECT) este un tratament local minim invaziv bazat pe un puls electric de înaltă tensiune combinat cu un medicament anticancer. Studiile preclinice și clinice au susținut utilizarea ECT la pacienții cu boală osoasă metastatică, demonstrând că nu afectează structura minerală a osului și capacitatea sa de regenerare și că este fezabilă și eficientă pentru tratamentul metastazelor osoase. Din 2009, 88 de pacienți cu metastaze osoase au primit ECT la Institutul Rizzoli. În 2014 a fost început un registru al pacienților cu metastaze osoase tratați cu ECT, ale căror date sunt înregistrate într-o bază de date partajată. Împărtășim experiența Institutului Rizzoli a 38 de pacienți tratați cu ECT pentru o metastază osoasă, excluzând pacienții neincluși în registru (înainte de 2014) și cei tratați cu fixare osoasă. Urmărirea medie a fost de 2 luni (1-52). Răspunsul la tratament folosind criteriile RECIST a fost de 29% răspunsuri obiective, 59% boală stabilă și 16% boală progresivă. Folosind PERCIST, răspunsul a fost de 36% OR, 14% SD și 50% PD, fără diferențe semnificative între cele două criterii. O scădere semnificativă a durerii și o mai bună calitate a vieții a fost observată la FU.Cuvinte cheie:
1. Introducere
Potrivit unei publicații Global Cancer Observatory (GLOBOCAN) 2020, cancerul este una dintre principalele cauze de deces la nivel mondial și cea mai semnificativă povară de boală la nivel global [
1 ]. În 2019, Mattizu et al. a publicat un articol de revizuire a epidemiologiei cancerului; per total, puțin mai mult de 18 milioane de cazuri noi de cancer au fost diagnosticate în 2018 [
2 ].Deși acest scenariu ar putea fi perceput ca descurajator, încă din 1970, odată cu implementarea chimioterapiei ca tratament adjuvant împreună cu radioterapia și rezecția chirurgicală, s-au făcut pași semnificativi către controlul bolii. Cu toate acestea, din cauza prelungirii timpului de supraviețuire și a ratelor de cancer crescând din cauza schimbărilor demografice, cazurile de cancer acumulate sunt în creștere [
3 ]. Acest număr compus de pacienți cu cancer a forțat furnizorii de asistență medicală să extindă opțiunile de tratament pentru a îmbunătăți calitatea vieții.Multe complicații pe care le pot experimenta pacienții cu cancer și le pot compromite calitatea vieții apar din metastazele osoase [
4 ]. Simptomele precum durerea, compresia măduvei spinării care are ca rezultat deteriorarea neurologică, dezechilibrele metabolice secundare hipercalcemiei și reducerea prelungită a mișcării din cauza fracturii patologice sau a riscului de fractură trebuie tratate. Osul este al treilea cel mai frecvent țesut țintă pentru metastaze. Cancerele pulmonare, de prostată, de sân, rinichi și tiroidian sunt responsabile pentru aproape 80% din aceste leziuni ale scheletului [
5 ,
6 ]. Tratamentul pacienților metastatici este multidisciplinar. Terapiile sistemice sunt esențiale, dar uneori trebuie adăugate tratamente locale pentru a rezolva sau preveni complicațiile ortopedice.Tratamentele locale standard includ radioterapia, intervenția chirurgicală, embolizarea, tratamentul cu ultrasunete focalizat sau crioterapia [
7 ,
8 ,
9 ,
10 ]. Electrochimioterapia (ECT) este un tratament local minim invaziv bazat pe combinația de impulsuri electrice de înaltă tensiune și medicamente anticancer. Datorită eficacității dovedite pentru tratarea tumorilor cutanate și subcutanate, aplicarea sa a fost extinsă și pentru tumorile interne. Studiile preclinice și clinice au susținut utilizarea ECT la pacienții cu boală osoasă metastatică, demonstrând că nu afectează structura minerală a osului și capacitatea sa de regenerare. Mai mult, studiile clinice au demonstrat fezabilitatea și eficacitatea electrochimioterapiei pentru tratamentul metastazelor osoase [
11 ,
12 ].Din 2009, 88 de pacienți cu metastaze osoase au primit ECT la Institutul Rizzoli. În 2014, a fost început un registru al pacienților cu metastaze osoase tratați cu ECT. De atunci, toate datele pacientului sunt înregistrate într-o bază de date partajată (
http://reinbone.wng.it accesată la 15 februarie 2022) protejată de parole de securitate.Această lucrare își propune să împărtășească experiența Institutului Rizzoli a 38 de pacienți care au primit ECT pentru tratarea metastazelor osoase ale căror date au fost înregistrate în baza de date. Au fost excluși optsprezece pacienți supuși fixației după ECT. Această decizie a fost sub premisa că, într-un fel, reacția osoasă la procedura de închilare intramedulară s-ar putea suprapune cu răspunsul ECT atunci când se evaluează vindecarea osoasă.
2. Materiale și metode
Din 2014 până în 2021, 56 de pacienți cu metastaze osoase au primit ECT la Institutul de Ortopedie Rizzoli. Acest studiu a fost aprobat de Comitetul Etic local (Comitato Etico di Area Vasta Emilia Centro della Regione Emilia-Romagna (CE-AVEC) Protocollo Generale 0028598, 25 august 2014). Criteriile de includere pentru tratamentul ECT au fost următoarele: vârsta > 18 ani și implicarea histologic dovedită a scheletului apendicular sau axial de carcinom metastatic sau melanom. Criteriile de excludere au fost următoarele: tulburări de coagulare, edem pulmonar sever sau fibroză, sarcină sau alăptare, alergie cunoscută la bleomicina sau doza cumulativă care depășește 400.000 UI și disfuncție renală cronică. Pentru această lucrare, au fost excluși 18 pacienți supuși fixației după ECT; de asemenea, un pacient a murit înainte de a atinge durata prevăzută de urmărire.Înainte de colectarea datelor, a fost solicitată aprobarea comitetului de etică și a autorității de protecție a datelor. Apoi, pentru grupul rămas de 38 de pacienți, au fost înregistrate date privind vârsta, diagnosticul, tratamentele anterioare, localizarea metastazelor, parametrii ECT și rezultatul clinic. Evaluarea imagistică pentru a evalua morfologia tumorală a inclus radiografii convenționale și RMN, CT cu îmbunătățirea contrastului sau scanări FDG-PET.Sistemul de electroporare utilizat a fost Cliniporator
® VITAE (IGEA SpA, Carpi, Italia). Hardware include electrozi de tip trocar cu diametrul de 1,8 mm. Selecția lungimii a fost în funcție de localizare, morfologie și deptate metastazei. Electrozii disponibili aveau o lungime totală pentru a alege între 12 și 20 cm compusă din două părți, una izolată pentru protecția țesuturilor moi și cealaltă considerată „partea activă” neizolata, care poate fi de 30 sau 40 mm. Diametrul, lungimea și poziționarea electrodului au fost selectate în conformitate cu o planificare preoperatorie atentă pentru a îndeplini cerințele de configurare pentru o electroporare eficientă.Folosind imagini radiologice diagnostice, leziunea de tratat a fost modelată folosind software-ul de planificare PULSAR specific (C3M, Center for Computational Continuum Mechanics, Ljubljana, Slovenia). Planificarea tratamentului a fost realizată luând în considerare dimensiunea și localizarea tumorilor individuale, în raport cu vasele de sânge majore și geometria preferată de inserare a electrozilor, astfel încât numărul și distribuția geometrică a electrozilor, distanțele acestora, perechile de electrozi pentru pulsul de livrare și impulsurile pentru fiecare pereche de electrozi au fost calculate cu precizie verificate. Această procedură a făcut posibilă determinarea poziționării optime a electrozilor pentru a asigura o electroporare completă și omogenă a masei tumorale.Procedura ECT a fost efectuată urmând ghidurile ESOPE [
13 ]. Opt impulsuri de 1000 V/cm între perechile de electrozi au furnizat un câmp electric omogen peste leziune. Au fost investigate și sunt disponibile în literatura de specialitate mai multe modele numerice ale câmpului electric generat de electrozii cu ac [
14 ], arătând că distribuția câmpului electric este optimă atunci când partea activă a electrozilor este plasată în interiorul locului de tratament, adică osul. leziune. În acest caz, câmpul electric generat în interiorul acestui material (care este omogen din punct de vedere al caracteristicilor electrice) poate fi ușor de prezis. Dacă electrozii sunt introduși corect în leziunea tumorală, osul și mușchii din jur nu vor afecta distribuția câmpului electric în interiorul leziunii. Mai mult, analiza cu feedback-ul dispozitivului a curentului electric care curge în timpul tratamentului poate ajusta în cele din urmă intensitatea pulsului electric și poate asigura cea mai mare acoperire a leziunii cu o intensitate suficientă a câmpului electric.Electrochimioterapia necesită acoperirea întregii tumori cu un câmp electric pulsat, a cărui distribuție depinde de biologia țesuturilor tratate.Cliniporator calculează cel mai potrivit câmp electric pentru a realiza electroporația în toate țesuturile tratate; după livrarea curentului, Cliniporatorul comunică dacă câmpul electric dintre perechile de electrozi a fost eficient în inducerea electroporării țesutului traversat de curent; dacă nu, mașina recalculează parametrii curentului, iar alimentarea electrică cu noii parametri se repetă apoi. În cazul leziunilor deosebit de complexe sau foarte inegale, planificarea pre-tratament poate fi o soluție bună pentru optimizarea procedurii.Bleomicina a fost chimioterapeuticul selectat cu o doză de 15 mg/m2
de suprafață corporală (Bleomicina Nippon Kayaku, Sanofi Aventis, Milano, Italia).După ce pacienții au suferit blocaj periferic sau anestezie generală, electrozii au fost poziționați cu asistență imagistică, folosind fie fluoroscopie, fie scanare CT. Apoi, a fost administrat intravenos în bolus de bleomicină și s-au așteptat 8 minute pentru a permite distribuția medicamentului. Apoi, electroporarea a fost efectuată imediat pentru a îndeplini limita de timp de 30 de minute după injectarea cu bleomicina pentru a fi eficientă.Evaluarea răspunsului clinic și radiologic a fost efectuată la două intervale de timp, primul în 60 până la 90 de zile după ECT și al doilea, în rândul pacienților supraviețuitori, la 6 luni. Pentru evaluarea clinică au fost depuse teste cuantificatoare pentru analiza datelor. Scala numerică vizuală a fost utilizată pentru a evalua durerea [
15 ], în timp ce chestionarul EQ-5D-3L și Scala ECOG de stare de performanță au fost aplicate pentru a evalua performanța generală [
16 ]. În plus, pentru a ajuta la evaluarea răspunsului tumoral, criteriile PERCIST și RECIST au fost utilizate atunci când a fost posibil [
17 ,
18 ].Variabilele continue au fost descrise prin valoare mediană și interval, medie și abatere standard. Variabilele categoriale au fost descrise prin număr absolut și procent. Relația dintre fiecare criteriu de răspuns a fost evaluată folosind un test Chi-pătrat sau, după caz, testul exact Fischer. Analiza logistică univariată a fost efectuată pentru identificarea variabilelor clinice sau instrumentale care ar putea influența rata de răspuns obiectiv în rândul celor înregistrate în baza de date; au fost raportate riscul relativ (RR) și valoarea
p . Datele au fost analizate statistic folosind testul Mann-Whitney U utilizat pentru analize neparametrice. Semnificația statistică a fost definită ca
p \0,05. Toate analizele au fost efectuate cu IBM SPSS versiunea 21.0 (IBM Co., Armonk, NY, SUA).
3. Rezultate
Un total de 38 de pacienți au îndeplinit criteriile noastre de includere. Vârsta mediană a celor 38 de pacienți a fost de 59 de ani (interval 41-91 de ani) și timpul median de la diagnosticarea tumorii primare a fost de 49 de luni (interval 0-226 de luni).
Tabelul 1 rezumă statistica descriptivă a cohortei de pacienți.
Tabelul 1. Statistica descriptivă a populației.

Treizeci și șapte de pacienți au fost supuși unei singure ședințe ECT, în timp ce unul a suferit două ședințe ECT, pentru o sumă totală de 39 de ședințe ECT. În funcție de dimensiunea și geometria tumorii, numărul de ace utilizate pentru fiecare ședință a variat de la 3 la 11. Pentru poziționarea corectă a electrodului, ghidarea scanării CT a fost utilizată în 16 cazuri și fluoroscopia în 22. Informații detaliate privind ședințele ECT și leziunile tratate sunt raportate în
Masa 2 . În două cazuri, leziunea a fost localizată în apropierea planului articular (acetabul), iar în acestea, tratamentul cu ECT nu a provocat leziuni articulației.
Tabelul 2. Descrierea detaliată a leziunilor tratate și a parametrilor ECT.

Cele mai tratate locuri au fost oasele lungi ale membrelor și pelvisul. Tratamentul cu electrozi cu geometrie variabilă necesită menținerea vârfurilor active ale electrozilor paralele între ele, iar acest lucru limitează utilizarea ECT în locurile vertebrale, pentru care este necesară introducerea electrozilor trans-peduncular. Cu toate acestea, în 2019, Cornelis et al. [
19 ] a arătat că este posibil să se efectueze ECT în situsurile vertebrale, în special pe cele lombare. Datorită apropierii pleurei de coaste, riscul de a provoca complicații pleuro-pulmonare odată cu introducerea electrozilor a determinat să nu efectuăm acest tratament în situsurile costale.Procedura totală a durat de la 20 la 80 de minute (mediana 40 de minute), în funcție de dimensiunea leziunii țintă. Durata mediană de urmărire a fost de 2,2 luni (interval 1-52 luni) cu o valoare medie de 6,6 ± 4,9 luni. Unul din 38 de pacienți a murit înainte de prima urmărire din cauza agravării rapide a condițiilor sistemice și a fost exclus. Prin urmare, urmărirea a fost disponibilă pentru 37 de pacienți, iar 15 dintre aceștia (39%) au realizat o urmărire mai lungă de trei luni cu o medie de 12,3 ± 14,5 luni.Un pacient a prezentat necroză cutanată precoce cu expunere osoasă după tratament, necesitând amputare. Pacientul era un bătrân de 91 de ani care suferea de carcinom spinocelular al antebrațului. A suferit excizie în masă și acoperire locală cu lambou. El a fost trimis din cauza unei recidive ulterioare cu invazie tumorală a 2/3 proximale a ulnei. Având în vedere extinderea leziunii, a fost propusă amputarea brațului. Pacientul a refuzat amputarea, așa că ECT a fost efectuată cu electrozi cu geometrie personalizată pentru a trata tumora pielii și extinderea acesteia în os. Cu toate acestea, necroza indusă de tratament a cauzat expunerea osului, necesitând în cele din urmă amputarea.Răspunsul la tratament este rezumat în
Tabelul 3. Răspunsul la tratament conform criteriilor RECIST și PERCIST și durerii pre și post-ECT (la urmărire precoce și tardivă).

În general, răspunsul la tratament după criteriile RECIST a cuprins nouă răspunsuri obiective (25%), trei răspunsuri complete (9%) și șase răspunsuri parțiale (16%). Douăzeci și doi de pacienți au avut o boală stabilă (59%) și șase o boală progresivă (16%).Conform criteriilor PERCIST, au fost înregistrate 13 răspunsuri obiective (36%), dintre care cinci complete (14%) și opt parțiale (22%). Cinci pacienți au avut o boală stabilă (14%) și 19 o boală progresivă (50%). Nu au fost observate diferențe semnificative între cele două criterii (
p = 0,44). Modelul logistic univariat a arătat că sexul, vârsta, histologia, numărul de metastaze și fracturile nu au influențat rezultatul. Doar ECOG 0-1 este un predictor al răspunsului obiectiv în această cohortă de pacienți (
p < 0,0001). Analizând rezultatul radiologic pe baza tipului de leziune (litică, sclerotică sau mixtă), din cele 29 de leziuni litice, trei au avut CR, cinci PR, 16 SD și patru PD (un caz nu a fost evaluabil din cauza decesului în decurs de o lună). ). Leziunea sclerotică a rămas stabilă radiologic; dintre cele opt leziuni mixte, una a prezentat un răspuns radiologic parțial, cinci au rămas stabile și două au progresat. Douăzeci și trei din cei 29 de pacienți cu leziuni osteolitice luau medicamente antiresorbție. Rezultatul radiologic al acestor pacienți nu a fost considerat a fi afectat de această terapie, deoarece aceasta a fost în curs de multe luni înainte de tratamentul ECT. În ceea ce privește intensitatea durerii înainte de ECT, patru pacienți (11%) nu au raportat durere, trei pacienți (8%) au avut durere ușoară, 18 (47%) au avut durere moderată și 13 (34%) au avut durere severă, cu o valoare mediană de 6 ± 2.7. Toți cei patru pacienți la care s-a efectuat tratamentul ECT în absența durerii prezentau o leziune litică la nivelul colului femural, loc în care, în cazul creșterii leziunii, riscul de fractură patologică crește odată cu indicația ulterioară pentru protecția chirurgicală de șold. Tratamentul în aceste cazuri a fost deci efectuat pentru a preveni complicațiile majore cu un tratament minim invaziv. În plus, analiza managementului durerii la acești pacienți a arătat că înainte de ECT, patru pacienți (11%) nu au avut nevoie de analgezice deoarece nu aveau durere. Șase pacienți (16%) au folosit uneori analgezice, alți șase (16%) au folosit continuu medicamente non-opioide, 18 (47%) au avut nevoie de opioide și trei (8%) au avut durere necontrolată (unul necunoscut).După ECT, din cei 37 de pacienți evaluabili, 25 au prezentat reducerea durerii (68%). Zece pacienți nu au prezentat nicio modificare a stării lor de durere (inclusiv cei patru pacienți fără durere înainte de ECT), iar doi au experimentat o agravare a durerii.Pentru a rezuma răspunsul la durere, 17 din 37 de pacienți (45%) au redus analgezicele după ECT, cu o îmbunătățire semnificativă a managementului farmacologic al durerii (
p = 0,0049).O scădere semnificativă a intensității durerii a fost observată la scara medie vizuală numerică (VNS) după ECT la vizitele de urmărire precoce (2 ± 2,7) și târziu (2 ± 2,6) privind valorile pre-ECT (
p < 0,0001 și
p = 0,0046). , respectiv).Corelând durerea cu imagistica cu raze X, dintre cei 25 de pacienți cu ameliorarea durerii, șapte au experimentat o recuperare osoasă substanțială, doi completă și cinci parțială. Ceilalți 17 pacienți au rămas fără modificări, iar unul a prezentat progresia bolii. În mijlocul celor patru pacienți fără durere (pre și post-ECT), calitatea osului s-a îmbunătățit la doi, iar ceilalți doi rămân fără modificări. În plus, dintre cei opt pacienți cu durere stabilă sau agravată, trei nu au avut modificări ale raze X și cinci au prezentat progresia bolii (
Figura 1 ).
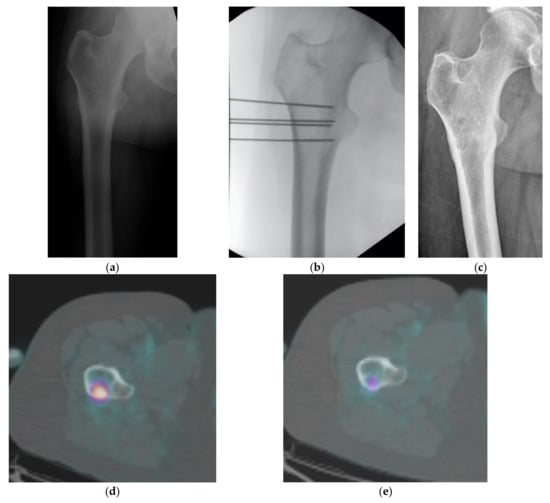
Figura 1. (
a –
e ) Femeie 47 de ani. Leziuni osteolitice în femurul proximal în metastazele osoase din carcinomul mamar tratat cu ECT. (
a ) Radiografie preoperatorie, (
b ) control fluoroscopic intraoperator, (
c ) 18 luni de urmărire: durerea a scăzut de la VNS 9 la 0/10 și leziunea s-a osificat parțial. Scanarea PET efectuată înainte de (
d ) și la 6 luni după tratament (
e ) arată un răspuns metabolic parțial al leziunii.Doisprezece pacienți au efectuat radioterapie locală cu cel puțin un an înainte de ECT (1 ± 0,8 ani). Un pacient a dus la CR, trei PR, șapte SD și un PD. Opt din 12 pacienți își îmbunătățesc performanța.În cele din urmă, nu există tendințe semnificative la itemii EQ-5D, probabil din cauza numărului redus de cazuri, cu excepția itemului durere (
p = 0,0450). Cu toate acestea, deși nu în mod semnificativ, este clar că starea de calitate a vieții s-a îmbunătățit la urmărire în comparație cu starea pre-ECT. Modelul logistic univariat a arătat că valorile ECOG 0-1 au fost asociate semnificativ cu o rată de răspuns obiectiv mai mare (
p < 0,0001).
4. Discutie
Boala osoasă metastatică este o problemă semnificativă de îngrijire a sănătății, care afectează 4,9 milioane de persoane din Statele Unite [
20 ]. Cancerul de prostată, sân, plămân, rinichi și tiroida reprezintă aproximativ 80% din cazuri.Principalele obiective la pacienții cu oase metastatice sunt controlul durerii și prevenirea progresiei locale a bolii care poate duce la o fractură patologică. În prezent, cu excepția pacientului în mod evident moribund, nu este încă posibil să se evalueze cu precizie supraviețuirea rămasă [
9 ,
21 ]. Natha și colab. [
22 ] a analizat supraviețuirea la pacienții tratați pentru fractură patologică și a constatat că supraviețuitorii scurti și intermediari au fost supraevaluați, iar supraviețuitorii lungi au fost subestimați în ceea ce privește durata așteptată a supraviețuirii.Deși rolul tratamentelor chirurgicale deschise cu osteosinteză pentru fracturile patologice și/sau rezecția metastazelor solitare în oasele lungi rămâne vital pentru deambularea independentă și calitatea vieții pentru acești pacienți, tehnicile minim invazive sunt sigure, cu puține complicații și rezultate optime pentru pacienții cu cancer cu metastaze osoase [
23 ].În prezent, nu există un singur tratament standard de aur pentru metastazele osoase și decizia între toate opțiunile disponibile este încă o provocare. Terapiile utilizate în mod obișnuit includ chimioterapiile anticancer sistemice asociate cu proceduri locale (de exemplu, chirurgie, radioterapie, ablație termică percutanată, crioablație, ciment osos, embolizare și ultrasunete focalizate).Chirurgia oferă stabilitate structurală, dar poate fi solicitantă din punct de vedere tehnic și asociată cu o recuperare prelungită.Radioterapia (RT) este cea mai frecvent utilizată terapie pentru tratarea locală a metastazelor osoase, cu rate estimate de ameliorare a durerii raportate în literatură între 50% și 80%. RT convențională a corpului extern este considerată un tratament neinvaziv, dar are complicații inerente toxicității tisulare. Fibroza, necroza osoasa sau insuficienta vasculara sunt prezente intr-o anumita masura in zonele supuse RT. Această toxicitate poate limita potențial RT repetitivă, adesea pentru 20% dintre pacienți sub regimuri cu o singură fracțiune și 8% din regimuri cu mai multe fracțiuni. În plus, ar putea compromite vindecarea rănilor atunci când sunt necesare proceduri chirurgicale viitoare [
24 ,
25 ]. Pentru a atenua unele dintre aceste dezavantaje și pentru a îmbunătăți delimitarea radiațiilor, a fost introdusă RT stereotactică pentru a trata metastazele osoase. Se consideră că permite doze mai mari de radiații respectând structurile învecinate [
25 ].Pentru a evita efectele secundare ale RT, au fost utilizate alte tehnologii mai recente. În ceea ce privește crioablația, Callstrom și colab. [
26 ] a raportat o rată de răspuns de 75% la 61 de pacienți cu metastaze osoase dureroase. Pusceddu et al. [
27 ] a descris o rată de ameliorare de 91% a scalei BPI la 12 săptămâni de urmărire și 72% dintre pacienți fără simptomatologie după ablația cu microunde.Dupuy et al. [
28 ] a sugerat utilizarea ablației cu radiofrecvență pentru tratamentul metastazelor osoase dureroase. În seria lor de pacienți studiată pe o perioadă de 3 luni, autorii au observat o îmbunătățire medie a simptomatologiei de 26/100. Rata de complicații a acestor tehnici este scăzută, variind între 0% (Pusceddu) și 5% (Dupuy). Bertrand şi colab. [
29 ] a raportat PR 50% (8/16) și CR 37,5% (6/16) la pacienții tratați cu ultrasunete focalizate. Utilizarea embolizării transarteriale asigură devascularizarea zonei țintă pentru a garanta siguranța și eficacitatea procedurilor efectuate ulterior [
30 ].Obiectivul comun tuturor tehnicilor de ablație este inducerea celei mai mari necroze termice posibile a leziunii țintă pentru a distruge nociceptorii periostali și a reduce dimensiunea cancerului. Nu există dovezi actuale care să favorizeze utilizarea unei tehnici de ablație față de alta. Pe de altă parte, acele tehnici duc la o necroză fizică a celulelor tumorale, în timp ce ECT asigură o necroză chimică: în 2010, un studiu realizat de Fini et al. [
31 ] a demonstrat activitatea osteogenă și integritatea structurală a trabeculelor osoase după electroporare. În plus, capacitatea de remodelare osoasă a fost păstrată [
31 ]. Câțiva ani mai târziu, în 2013, un studiu preclinic in vivo și in vitro a arătat că ECT ar putea fi sigură, eficientă și minim invazivă pentru tratarea metastazelor osoase [
11 ].ECT nu induce necroză osoasă și, prin urmare, în cazul fracturii osului tratat cu ECT, vindecarea este posibilă cu calitatea obișnuită a calusului fracturii și timpul de vindecare [
12 ]. Între tratamentele locale, ECT reprezintă o alegere bună deoarece este minim invazivă și respectă structura osoasă.Durerea este unul dintre cei mai relevanți indicatori ai calității vieții la pacienții care urmează tratamente paliative. Ameliorarea durerii a fost obținută la 68% dintre pacienți, iar utilizarea analgezicelor a scăzut la 45% dintre aceștia. Rezultatele noastre arată o reducere semnificativă a durerii după ECT la mai mult de jumătate dintre pacienți la urmărirea precoce. Mai mult, am observat o reducere a durerii chiar și în absența unui răspuns radiologic obiectiv.Totuși, dacă luăm în considerare răspunsul radiologic (RECIST și PERCIST) în sine, se pare că răspunsul obiectiv la ECT nu este foarte favorabil. Cu toate acestea, printre pacienții cu ameliorarea durerii după ECT și cei fără durere înainte de tratament (29 de pacienți), progresia radiologică reală a bolii a fost prezentă la un singur pacient. În plus, modificările obiective în imagistica de control au arătat un comportament stabil al metastazelor în 19 cazuri și o îmbunătățire (completă sau parțială) în nouă.Complicațiile legate de ECT sunt de obicei puține, previzibile și evitabile. În cohorta noastră de pacienți, complicațiile asociate cu ECT au fost raportate la un singur pacient, care a dezvoltat necroză tisulară. Riscul de necroză a pielii și ulcerație cu expunerea ulterioară a osului la pacienții cu o calitate slabă a țesuturilor moi sau zone iradiate anterior a fost deja descris [
12 ,
32 ]. Această complicație poate fi diminuată prin introducerea părții active a electrozilor dincolo de stratul epidermic evitând afectarea pielii, prevenind astfel expunerea osului.
5. Concluzii
În concluzie, ECT oferă posibilitatea de a utiliza chimioterapia, un tratament sistemic, în mod localizat. Deși nu este un tratament fără complicații, dezavantajele pot fi reduse substanțial printr-o planificare preoperatorie meticuloasă și o selecție atentă a cazurilor. În plus, invers față de alte tratamente locale pentru metastazele osoase, ECT scutește structura osoasă mineralizată de deteriorarea ireversibilă, permițând vindecarea osoasă. În cele din urmă, ECT este un instrument valoros pentru a atenua durerea și pentru a îmbunătăți calitatea vieții pentru acei pacienți care se confruntă cu povara metastazelor osoase.
Contribuții ale autorului
Concepție și proiectare studiu: LC (Laura Campanacci); Achizitie de date: LC (Laura Campanacci); Analiza și interpretarea datelor: FDT; Redactare manuscris: LC (Luca Cevolani), LS, NA, GB; Revizie critică: DMD Toți autorii au citit și au fost de acord cu versiunea publicată a manuscrisului.
Finanțarea
Această cercetare nu a primit finanțare externă.
Declarația Comisiei de revizuire instituțională
Acest studiu a fost aprobat de Comitetul Etic local (Comitato Etico di Area Vasta Emilia Centro della Regione Emilia-Romagna (CE-AVEC) Protocollo Generale 0028598, 25 august 2014).
Declarație de consimțământ informat
Consimțământul informat a fost obținut de la toți subiecții implicați în studiu.
Declarație de disponibilitate a datelor
http://reinbone.wng.it (accesat la 15 februarie 2022).
Conflicte de interes
Autorii nu declară niciun conflict de interese.
Referințe
- Sung, H.; Ferlay, J.; Siegel, RL; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray, F. Statistici globale de cancer 2020: Estimări GLOBOCAN ale incidenței și mortalității la nivel mondial pentru 36 de cancere din 185 de țări. CA Cancer J. Clin. 2021 , 71 , 209–249. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mattiuzzi, C.; Lippi, G. Epidemiologia actuală a cancerului. J. Epidemiol. Glob. Sănătate 2019 , 9 , 217–222. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versiunea verde ]
- Jörling, M.; Rutzner, S.; Hecht, M.; Fietkau, R.; Distel, LV Deteriorarea scorurilor legate de sănătatea calității vieții sub tratament prezice o supraviețuire mai lungă. BioMed Res. Int. 2020 , 2020 , e3565238. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yu, H.-HM; Tsai, Y.-Y.; Hoffe, SE Privire de ansamblu asupra diagnosticului și managementului bolii metastatice osoase. Controlul cancerului. J. Moffitt Cancer Center 2012 , 19 , 84–91. [ Google Scholar ]
- Fornetti, J.; Welm, AL; Stewart, SA Înțelegerea osului în metastaza cancerului. J. Bone Min. Res. 2018 , 33 , 2099–2113. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Bickels, J.; Dadia, S.; Lidar, Z. Managementul chirurgical al bolii osoase metastatice. J. Bone Jt. Surg Am. 2009 , 91 , 1503–1516. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Chow, E.; Harris, K.; Fan, G.; Tsao, M.; Sze, WM Studii de radioterapie paliativă pentru metastaze osoase: o revizuire sistematică. J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol. 2007 , 25 , 1423–1436. [ Google Scholar ] [ CrossRef ]
- Rossi, G.; Mavrogenis, AF; Casadei, R.; Bianchi, G.; Romagnoli, C.; Rimondi, E.; Ruggieri, P. Embolizarea metastazelor osoase din cancerul renal. Radiol. Medica 2013 , 118 , 291–302. [ Google Scholar ] [ CrossRef ]
- Tsukamoto, S.; Kido, A.; Tanaka, Y.; Facchini, G.; Peta, G.; Rossi, G.; Mavrogenis, AF Prezentare generală curentă a tratamentului pentru boala osoasă metastatică. Curr. Oncol. 2021 , 28 , 3347–3372. [ Google Scholar ] [ CrossRef ]
- Luigi Cazzato, R.; Auloge, P.; De Marini, P.; Rousseau, C.; Chiang, JB; Koch, G.; Caudrelier, J.; Rao, P.; Garnon, J.; Gangi, A. Ablația percutanată ghidată de imagine a metastazelor osoase: Controlul tumorii locale la pacienții oligometastatici. Int. J. Hyperth. 2018 , 35 , 493–499. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Fini, M.; Salamanna, F.; Parrilli, A.; Martini, L.; Cadossi, M.; Maglio, M.; Borsari, V. Electrochimioterapia este eficientă în tratamentul metastazelor osoase de șobolan. Clin. Exp. Metastasis 2013 , 30 , 1033–1045. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bianchi, G.; Campanacci, L.; Ronchetti, M.; Donati, D. Electrochimioterapia în tratamentul metastazelor osoase: un studiu de fază II. Lumea J. Surg. 2016 , 40 , 3088–3094. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Mir, LM; Gehl, J.; Sersa, G.; Collins, CG; Garbay, J.-R.; Billard, V.; Geertsen, PF; Rudolf, Z.; O’Sullivan, GC; Marty, M. Proceduri standard de operare ale electrochimioterapiei: Instrucțiuni pentru utilizarea bleomicinei sau cisplatinei administrate fie sistemic, fie local și impulsuri electrice furnizate de CliniporatorTM prin intermediul electrozilor invazivi sau neinvazivi. EURO. J. Cancer Suppl. 2006 , 4 , 14–25. [ Google Scholar ] [ CrossRef ]
- Cindrič, H.; Kos, B.; Tedesco, G.; Cadossi, M.; Gasbarrini, A.; Miklavčič, D. Electrochimioterapia metastazelor spinale folosind abordarea transpediculară-Un studiu de fezabilitate numerică. Tehnol. Cancer Res. Trata. 2018 , 17 , 1533034618770253. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Ritter, PL; González, VM; Laurent, DD; Lorig, KR Măsurarea durerii folosind scala numerică vizuală. J. Rheumatol. 2006 , 33 , 574–580. [ Google Scholar ]
- de Kock, I.; Mirhosseini, M.; Lau, F.; Thai, V.; Downing, M.; Quan, H.; Lesperance, M.; Yang, J. Conversia Karnofsky Performance Status (KPS) și Eastern Cooperative Oncology Group Performance Status (ECOG) la Palliative Performance Scale (PPS) și interschimbabilitatea PPS și KPS în instrumentele de prognostic. J. Palliat. Care 2013 , 29 , 163–169. [ Google Scholar ] [ CrossRef ]
- O, JH; Lodge, MA; Wahl, RL Practic PERCIST: Un ghid simplificat pentru criteriile de răspuns PET în tumorile solide 1.0. Radiologie 2016 , 280 , 576–584. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Therasse, P.; Arbuck, SG; Eisenhauer, EA; Wanders, J.; Kaplan, RS; Rubinstein, L.; van Glabbeke, M.; van Oosterom, AT; Christian, MC; Gwyther, SG Noi linii directoare pentru a evalua răspunsul la tratament în tumorile solide. Organizația Europeană pentru Cercetare și Tratamentul Cancerului, Institutul Național al Cancerului din Statele Unite, Institutul Național al Cancerului din Canada. J. Natl. Cancer Inst. 2000 , 92 , 205–216. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Cornelis, FH; Ben Ammar, M.; Nouri-Neuville, M.; Matton, L.; Benderra, MA; Gligorov, J.; Jansa, R.; Plesnik, B.; Bosnjak, M.; Tratar, UL; et al. Electrochimioterapia percutanată ghidată de imagini a metastazelor coloanei vertebrale: experiență inițială. Cardiovasc. Interv. Radiol. 2019 , 42 , 1806–1809. [ Google Scholar ] [ CrossRef ]
- Biermann, JS; Holt, GE; Lewis, VO; Schwartz, HS; Yaszemski, MJ Boala osoasă metastatică: diagnostic, evaluare și tratament. J. Bone Jt. Surg. A.m. 2009 , 91 , 1518–1530. [ Google Scholar ]
- Wedin, R. Tratamentul chirurgical al fracturii patologice. Acta Orthop. Scand. Supl. 2001 , 72 , 1–29. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Nathan, SS; Healey, JH; Mellano, D.; Hoang, B.; Lewis, I.; Morris, CD; Athanasian, EA; Boland, PJ Supraviețuirea la pacienții operați de fractură patologică: Implicații pentru îngrijirea ortopedică la sfârșitul vieții. J. Clin. Oncol. 2005 , 23 , 6072–6082. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Smith, HS Metastaze osoase dureroase. Medicul durerii 2011 , 14 , E373–E403. [ Google Scholar ] [ CrossRef ]
- Kougioumtzopoulou, A.; Zygogianni, A.; Liakouli, Z.; Kypraiou, E.; Kouloulias, V. Rolul radioterapiei în metastazele osoase: O revizuire critică a literaturii actuale. EURO. J. Cancer Care 2017 , 26 , e12724. [ Google Scholar ] [ CrossRef ]
- Agarawal, JP; Swangsilpa, T.; van der Linden, Y.; Rades, D.; Jeremic, B.; Hoskin, PJ Rolul radioterapiei cu fascicul extern în managementul metastazelor osoase. Clin. Oncol. R. Coll. Radiol. 2006 , 18 , 747–760. [ Google Scholar ] [ CrossRef ]
- Callstrom, MR; Dupuy, DE; Solomon, SB; Beres, RA; Littrup, PJ; Davis, KW; Paz-Fumagalli, R.; Hoffman, C.; Atwell, TD; Charboneau, JW; et al. Crioablația percutanată ghidată de imagine a metastazelor dureroase care implică os: studiu multicentric. Cancer 2013 , 119 , 1033–1041. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versiunea verde ]
- Pusceddu, C.; Sotgia, B.; Fele, RM; Melis, L. Tratamentul metastazelor osoase cu ablație termică cu microunde. J. Vasc. Interv. Radiol. 2013 , 24 , 229–233. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dupuy, DE; Liu, D.; Hartfeil, D.; Hanna, L.; Blume, JD; Ahrar, K.; Lopez, R.; Safran, H.; DiPetrillo, T. Ablația percutanată cu radiofrecvență a metastazelor osoase dureroase: un studiu multicentric al Colegiului American de Imagini de Radiologie. Cancer 2010 , 116 , 989–997. [ Google Scholar ] [ CrossRef ] [ Versiunea verde ]
- Bertrand, A.-S.; Iannessi, A.; Natale, R.; Beaumont, H.; Patriti, S.; Xiong-Ying, J.; Baudin, G.; Thyss, A. Ecografia focalizată pentru tratamentul metastazelor osoase: Eficacitate și fezabilitate. J. Ther. Ultrasunete 2018 , 6 , 8. [ Google Scholar ] [ CrossRef ]
- Uemura, A.; Fujimoto, H.; Yasuda, S.; Osaka, I.; Goto, N.; Shinozaki, M.; Ito, H. Embolizare arterială transcateter pentru metastazele osoase din carcinomul hepatocelular. EURO. Radiol. 2001 , 11 , 1457–1462. [ Google Scholar ] [ CrossRef ]
- Fini, M.; Tschon, M.; Ronchetti, M.; Cavani, F.; Bianchi, G.; Mercuri, M.; Alberghini, M.; Cadossi, R. Ablația celulelor osoase prin electroporare. J. Bone Jt. Surg. Br. 2010 , 92 , 1614–1620. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Campanacci, L.; Bianchi, G.; Cevolani, L.; Errani, C.; Ciani, G.; Facchini, G.; Spinnato, P.; Tognù, A.; Massari, L.; Cornelis, FH Proceduri operaționale pentru electrochimioterapia în metastazele osoase: Rezultatele unui studiu prospectiv multicentric pe 102 pacienți. European. J. Surg. Oncol. 2021 , 47 , 2609–2617. [ Google Scholar ] [ CrossRef ] [ PubMed ]
| Nota editorului: MDPI rămâne neutru în ceea ce privește revendicările jurisdicționale în hărțile publicate și afilierile instituționale. |
© 2022 de către autori. Licențiat MDPI, Basel, Elveția. Acest articol este un articol cu acces liber distribuit în conformitate cu termenii și condițiile licenței Creative Commons Attribution (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).