- Daniela Koppold-Liebscher ,
- Christian S. Kessler ,
- Nico Steckhan ,
- Vanessa Bähr ,
- Cornelia Kempter ,
- Manfred Wischnewsky ,
- Marisa Hübner ,
- Barbara Kunz ,
- Marion Paul ,
- Stefanie Zorn ,
- Sophia Sari ,
- Michael Jeitler ,
- Rainer Stange și
- Andreas Michalsen
Încercări volum 21 , Număr articol: 854 ( 2020 ) Citați acest articol
- 22k accesări
- 13 Citate
- 4 Altmetric
- MetriciDetalii
Abstract
Context/obiective
Câteva studii preliminare au documentat siguranța și fezabilitatea postului repetat pe termen scurt la pacienții supuși chimioterapiei. Cu toate acestea, există o lipsă de date din studiile randomizate mai mari privind efectele postului pe termen scurt asupra calității vieții, reducerea efectelor secundare în timpul chimioterapiei și o posibilă reducere a progresiei tumorii. Mai mult, nu sunt disponibile date despre eficacitatea abordărilor de post în comparație cu așa-numitele diete sănătoase. Ne propunem să investigăm dacă efectele potențial benefice ale postului pe termen scurt pot fi confirmate într-un studiu randomizat mai amplu și se pot compara în mod favorabil cu o dietă integrală pe bază de plante.
Metode
Acesta este un studiu intervențional multicentric, randomizat, controlat, cu două brațe, cu o repartizare în grup paralel. O sută cincizeci de pacienți, inclusiv 120 de pacienți cu cancer de sân și 30 de pacienți cu cancer ovarian, vor fi randomizați la una dintre cele două intervenții nutriționale care însoțesc chimioterapia: (1) post repetat de scurtă durată, cu un aport maxim de energie de 350-400 kcal pe post. zile sau (2) dietă repetată pe termen scurt pe bază de plante normocalorică cu restricție de carbohidrați rafinați. Rezultatul primar este calitatea vieții legată de boală, așa cum este evaluată prin evaluarea funcțională a sistemului de măsurare a terapiei bolilor cronice. Rezultatele secundare includ modificări ale Scorului de anxietate și depresie a spitalului, precum și frecvența și severitatea efectelor secundare induse de chimioterapie pe baza criteriilor comune de terminologie ale evenimentelor adverse. Analiza explorativă într-o subpopulație va compara remisiile complete histologice la pacienții cu tratamente neoadjuvante.
Discuție/rezultatele planificate
Datele preclinice și un număr mic de studii clinice sugerează că postul repetat pe termen scurt poate reduce efectele secundare ale chimioterapiei, poate îmbunătăți calitatea vieții și, în cele din urmă, poate încetini progresia tumorii. Cercetările experimentale sugerează că efectele postului pot fi parțial cauzate de restricția proteinelor animale și a carbohidraților rafinați. Acest studiu este primul studiu clinic de confirmare, controlat randomizat, care compară efectele postului de scurtă durată cu o dietă pe termen scurt, pe bază de plante, cu conținut scăzut de zahăr în timpul chimioterapiei asupra calității vieții și remisiunii tumorii histologice.
Înregistrare de probă
ClinicalTrials.gov NCT03162289 . Înregistrat pe 22 mai 2017
Rapoarte de evaluare inter pares
fundal
În ultimii ani, postul pe termen scurt (STF) ca formă distinctă de restricție calorică a fost investigat pe larg, în special în experimente pe animale, dar și în unele studii clinice. Până acum, rezultatele indică efecte favorabile ale STF în termeni preventivi și terapeutici asupra bolilor degenerative, imunologice, inflamatorii și metabolice: constatările sunt consecvente la toate speciile [ 1 , 2 , 3 , 4 , 5 , 6 , 7 ]. Primatele și rozătoarele prezintă un risc redus de a dezvolta cancer dacă sunt expuse la STF [ 1 , 8 ]. Studiile clinice privind STF la oameni sunt rare și sunt utilizate diferite definiții ale postului pe termen scurt sau intermitent [ 9 , 10 , 11 ]. Până acum, nu a existat o definiție standard convenită în unanimitate, fie a postului pe termen scurt, fie a postului intermitent. Fiind unul dintre cele mai importante centre de cercetare la nivel mondial pentru postul clinic, folosim termenul „post pe termen scurt” pentru a ne referi la perioadele de post care depășesc postul intermitent tipic sau alimentația cu restricții de timp, cuprinsă între 12 și 48 de ore. Mai precis, folosim termenul STF în studiul nostru pentru a defini o restricție calorică subtotală de 60-72 de ore, așa cum am făcut într-o publicație anterioară [ 12 ]. Astfel, în definiția noastră, postul intermitent diferă de STF în principal prin durata sa.
Pentru pacienții cu cancer, chimioterapia este de obicei percepută ca o povară fizică și psihologică puternică și poate provoca efecte secundare acute și pe termen lung. Chimioterapia poate fi chiar întreruptă din cauza severității efectelor sale secundare, neatingând astfel obiectivele de a reduce dimensiunea tumorii sau de a elimina tumora. Cu excepția administrării anumitor medicamente (de exemplu, antiemetice [ 13 , 14 ]) și a exercițiilor terapeutice [ 15 , 16 ], doar câteva intervenții sunt cunoscute pentru a ajuta la reducerea efectelor secundare induse de chimioterapie [ 17 ]. Prin urmare, există o nevoie evidentă de intervenții suplimentare care ar putea îmbunătăți toleranța la chimioterapie.
Experimental, s-a demonstrat că postul pe termen scurt induce un „mod de protecție” în celulele sănătoase împotriva toxicității chimioterapeutice, în timp ce crește susceptibilitatea celulelor tumorale la chimioterapie [ 18 ]. Acest efect diferențial al postului asupra susceptibilității celulare în situația chimioterapiei a fost descris ca „rezistență diferențială la stres” (DSR) [ 19 , 20 ]. În celulele sănătoase, postul declanșează modificări distincte de protecție metabolică și ale expresiei genelor, cum ar fi reglarea în sus a mecanismelor de reparare a ADN-ului, autofagia și schimbarea în jos a căilor metabolice, inclusiv semnalizarea dependentă de IGF-1 [ 21 ]. Acest lucru nu numai că limitează creșterea și proliferarea celulelor, dar activează și căile de semnalizare pentru a proteja celulele sănătoase împotriva speciilor reactive de oxigen (ROS) produse de chimioterapice. Celulele canceroase, pe de altă parte, sunt în mare măsură independente de semnalele proliferative și insensibile la semnalele anti-proliferative [ 18 ]. În consecință, celulele canceroase sunt insuficient capabile să se adapteze la concentrații reduse de glucoză, factori de creștere și alte semnale cauzate de post și restricție calorică și, prin urmare, sunt mai susceptibile la chimioterapie [ 22 ]. Deoarece STF nu este asociat cu pierderea în greutate pe termen lung [ 23 ], care poate înrăutăți semnificativ prognosticul pacienților cu cancer [ 24 , 25 ], a fost evaluat în studii pilot timpurii ca un potențial tratament de susținere în chimioterapie [ 23 ]. Experimental, combinația de post și chimioterapie pare a fi mai eficientă decât chimioterapia singură în ceea ce privește eficacitatea și tolerabilitatea, în special în cancerul de sân [ 4 , 18 , 26 ].
Într-o serie de cazuri pe pacienți cu o varietate de afecțiuni maligne, au fost documentate efectele benefice ale STF; au fost demonstrate fezabilitatea STF și o reducere a severității efectelor secundare induse de chimioterapie [ 27 ]. Efectele STF au fost investigate în alte două studii pilot mici. Într-un studiu controlat pe 13 paciente cu cancer de sân, s-au observat îmbunătățiri ale toxicității hematologice după o perioadă de post de 48 de ore [ 11 ]. Într-un studiu necontrolat de fezabilitate și efect al dozei, 20 de pacienți aflați sub chimioterapie cu platină au fost comparați după perioade de post de 24, 48 și 72 de ore, iar afectarea ADN-ului redusă a fost documentată la pacienții care țineau timp de 48 de ore sau mai mult [ 10 ].
Un studiu pilot anterior, anterior studiului descris aici, incluzând 34 de paciente fie cu cancer de sân ( n = 30) fie cu cancer ovarian ( n = 4) supuse chimioterapiei într-un design încrucișat, a arătat efecte favorabile ale ciclurilor de chimioterapie cu STF față de ciclurile de chimioterapie normocalorică. . STF în timpul chimioterapiei a fost sigur și fezabil și au fost observate efecte pozitive asupra calității vieții, bunăstării și oboselii [ 12 ].
Discutăm dacă efectele anti-cancer ale postului rezultă dintr-o reducere a factorului de creștere asemănător insulinei-1 (IGF-1), mTOR și/sau reglarea moleculelor semnal p53 care îl însoțesc [ 21 , 28 , 29 ]. Deoarece IGF-1 promovează proliferarea celulară și inhibă apoptoza, reducerea sa joacă un rol cheie în protecția împotriva cancerului la mamifere [ 30 , 31 ]. Datele experimentale sugerează că nivelurile serice reduse de IGF-1 nu sunt doar un rezultat al postului, ci pot fi, de asemenea, un rezultat al restricției proteinelor alimentare [ 32 ]. De asemenea, o restricție calorică de 50% pe termen scurt în combinație cu o reducere masivă a proteinelor dietetice a condus la o îmbunătățire a rezistenței la chimiotoxicitate la șoareci [ 32 , 33 ]. O dietă pe bază de plante poate fi o modalitate foarte eficientă de restricție a proteinelor alimentare, deoarece plantele în general conțin mai puține proteine decât cantități egale de produse de origine animală și, prin urmare, pot duce la o reducere a nivelurilor de IGF-1 [ 34 ].
Rămâne astfel o întrebare deschisă de cercetare dacă efectele benefice ale STF pot fi confirmate în studii clinice mai mari și dacă acestea se datorează restricției calorice subtotale în sine sau absenței proteinelor animale și/sau carbohidraților rafinați [ 35 ].
Pe baza celor de mai sus, am conceput un protocol pentru un studiu clinic controlat randomizat multicentric care intenționează să testeze următoarea ipoteză. Chimioterapia pentru tratamentul adjuvant și neoadjuvant al cancerului de sân și al cancerului ovarian este mai eficientă și mai bine tolerată atunci când este combinată cu postul de scurtă durată. Comparăm acest lucru cu chimioterapia combinată cu o dietă pe termen scurt pe bază de plante, caracterizată printr-o restricție de proteine animale și carbohidrați rafinați.
Metode/proiectare
Design de studiu
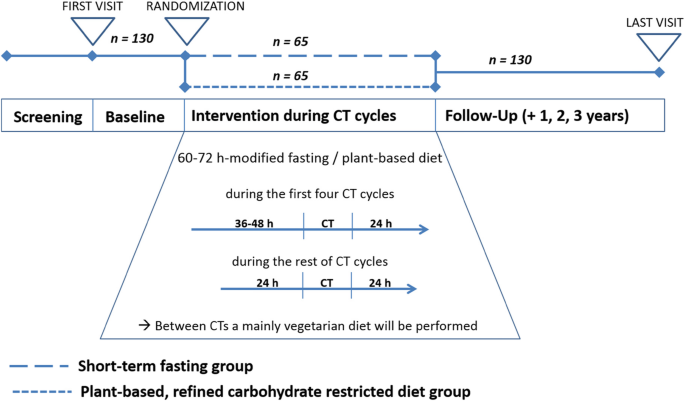
Acesta este un studiu de intervenție multicentric, randomizat controlat, cu două brațe, cu o repartizare în grup paralel. Obiectivul principal al acestui studiu este de a evalua eficacitatea celor două intervenții alimentare de susținere de mai sus la pacienții cu cancer de sân sau cancer ovarian supuși chimioterapiei. Eficacitatea este măsurată prin calitatea vieții, reducerea efectelor secundare induse de chimioterapie și remisiunea histologică în regimurile neoadjuvante.
Este planificat să includă 150 de femei participante, inclusiv 120 de paciente cu cancer de sân și 30 de paciente cu cancer ovarian. Recrutarea a început în mai 2017 (identificatorul ClinicalTrials.gov NCT03162289 ). Pacienții sunt recrutați în 8 centre specializate diferite (7 unități spitalicești și 1 centru ambulatoriu) pentru tratamentul cancerelor ginecologice din trei orașe germane (Berlin, Freiburg, Ludwigsburg) din două state federale germane diferite. Participanții la studiu sunt randomizați la una dintre cele două intervenții alimentare. Toți participanții participă la centrele lor de studiu respective pentru șase vizite de studiu: la momentul inițial, după 4 luni, la sfârșitul chimioterapiei și la vizitele de urmărire la 1, 2 și 3 ani după momentul inițial (vezi Fig. 1 pentru vizualizare).
Consiliul de evaluare instituțional al Charité Universitätsmedizin Berlin, precum și comisiile de etică atât din statul federal Baden-Württemberg, cât și din Albert-Ludwigs-Universität din Freiburg au aprobat protocolul de studiu. Toți participanții la studiu trebuie să depună consimțământul informat scris înainte de a putea fi incluși în cercetare. Studiul va fi realizat în conformitate cu Declarația de la Helsinki, astfel cum a fost modificată; liniile directoare ale Conferinței internaționale privind armonizarea bunei practici clinice (ICH-GCP); și legislația germană aplicabilă. Monitorizarea va urma ghidurile ICH-GCP.
Recrutare și randomizare
În scopuri de recrutare, broșuri cu informații despre studiu sunt distribuite în toate centrele de studiu participante. Pacienții sunt invitați să se alăture studiului de către anchetatori și asistentele medicale responsabile, fie direct atunci când diagnosticul este comunicat, fie ca parte a protocolului conferinței tumorale. Informații detaliate atât cu privire la antecedentele, cât și la protocolul studiului sunt furnizate pacienților oral și în formă scrisă cu cel puțin 24 de ore înainte de vizita de referință, iar la toate întrebările participanților li se răspunde înainte de a le permite să semneze formularul scris de consimțământ informat. Pe formularul de consimțământ, participanții sunt întrebați dacă sunt de acord cu utilizarea datelor lor în cazul în care aleg să se retragă din proces. De asemenea, participanților li se cere să acorde permisiunea echipei de cercetare pentru a partaja date relevante cu persoane din centrele de cercetare cooperante sau de la autoritățile de reglementare. Ei sunt, de asemenea, informați că acest proces presupune colectarea de specimene biologice pentru depozitare. Formularul de consimțământ informat poate fi găsit în fișierul suplimentar 5 al acestei publicații.
Eligibilitatea pacienților este determinată în timpul vizitelor de screening de către anchetatori, printr-un document de screening care conține toate criteriile de includere și excludere. Numai dacă toate criteriile de includere și nicio excludere sunt îndeplinite, pacientul poate fi inclus în studiu. Randomizarea este stratificată în funcție de tipul de cancer (sân sau ovarian) și se bazează pe randomizarea blocului cu lungime variabilă a blocului. Randomizarea în bloc este o tehnică folosită în mod obișnuit în proiectarea studiilor clinice pentru a reduce părtinirea și pentru a atinge echilibrul în alocarea participanților la brațele de tratament. Această metodă crește probabilitatea ca fiecare braț să conțină un număr egal de indivizi prin secvențierea asignărilor participanților pe bloc. Alocarea aleatorie a participanților la unul dintre cele două grupuri de intervenție se realizează într-un raport de 1:1. Procedura de randomizare este realizată de o aplicație web concepută pentru studiu ( https://natur.charite.de/randoFIT2 ). Aplicația rulează pe un server al Charité Universitätsmedizin Berlin folosind Shiny Server [ 36 ]. Fiecare centru de studii are propriul său login securizat la această aplicație web.
Ascunderea secvenței de alocare asigură implementarea strictă a secvenței de alocare fără cunoașterea prealabilă a sarcinilor de intervenție. În primul rând, se va lua decizia de a accepta sau respinge un participant, apoi se va obține consimțământul informat de la participant, în ignorarea următoarei sarcini din secvență. După aceasta, alocarea și ID-ul de studiu al participantului corespunzător sunt generate pentru acest pacient de către aplicația web. Aceste două valori sunt transmise de pe serverul Charité pe o tabletă la sfârșitul unui chestionar la care participantul trebuie să răspundă. Personalul studiului aflat în contact direct cu participanții la studiu, care efectuează recrutări, vizite, traininguri sau apeluri telefonice, nu are acces la lista de randomizare. Acest personal nu este orbit, deoarece există contact direct cu participanții. Astfel, designul este deschis, doar analiștii de date fiind orbiți. Statisticienii care analizează datele vor fi dezvăluiți față de alocare, numai după ce toate datele au fost colectate, introduse în baza de date și curățate. Nu sunt planificate analize intermediare, deoarece nu anticipăm probleme în detrimentul participanților.
Starea procesului
Din mai 2017 și probabil până în august 2020, participanții vor fi recrutați. A treia și în prezent ultima versiune de protocol a fost tradusă și poate fi găsită în suplimente. Această a treia versiune modificată a protocolului a fost revizuită și aprobată de comitetul de etică al Charité Universitätsmedizin Berlin în iulie 2018, urmată de consiliile de evaluare etică ale Albert-Ludwigs-Universität în octombrie 2018 și de asociația medicală din Baden-Württemberg în decembrie 2018.
Participanții
Criterii de includere
Principalele criterii de includere sunt un diagnostic confirmat de cancer de sân sau cancer ovarian fără metastaze la distanță, vârsta cuprinsă între 18 și 75 de ani și chimioterapia adjuvantă sau neoadjuvantă cu unul dintre următoarele regimuri:
- Cancer de sân: 4x epirubicină sau adriamicină (doxorubicină) și ciclofosfamidă (EC sau AC, respectiv) tri-săptămânal, urmate de 12 cicluri de paclitaxel săptămânal [ 37 ] sau 4 cicluri de docetaxel tri-săptămânal [ 38 ]
- Cancer ovarian: chimioterapie conform protocoalelor actuale, cel puțin 4 cicluri planificate de chimioterapie care conțin carboplatină [ 39 , 40 ]
Criteriu de excludere
Criteriile de excludere sunt subponderea existentă (IMC < 19 kg/m 2 ) sau reducerea greutății > 3 kg sau > 5 kg în ultimele 1 sau, respectiv, 3 luni; o tulburare de alimentație prediagnosticată (anorexie, bulimie, tulburare de alimentație excesivă); insuficiență renală (creatinină > 2 mg/dl); diabet zaharat de tip 1 sau tratament cu insulină; comorbiditate internă sau psihiatrică severă; boli terminale; boli cu o reducere semnificativă a mobilității; includerea într-un alt protocol de studiu; și absența accesului la e-mail și la internet.
Criteriile de întrerupere a intervenției sunt retragerea consimțământului și motivele medicale pentru oprirea intervenției, de exemplu, o reducere a IMC la < 18 kg/m 2 sau spitalizarea din cauza reacțiilor adverse induse de chimioterapie. Participanții care întrerup intervenția sunt rugați să participe la toate vizitele de studiu rămase și să completeze chestionare de urmărire în afara protocolului de studiu.
Intervenții de studiu
Cele două intervenții de studiu sunt (1) STF și (2) o dietă normocalorică pe bază de plante cu restricție de carbohidrați rafinați. Pentru a maximiza înțelegerea și aderarea la aceste două intervenții alimentare diferite, toți participanții primesc o sesiune de consiliere nutrițională. Consilierea nutrițională introductivă are loc într-un interval de timp de 1 săptămână până la 2 zile înainte de prima chimioterapie, într-o ședință individuală, de 60 de minute, cu un nutriționist special instruit. Toți nutriționiștii dețin o diplomă de la una dintre academiile de post certificate din Germania [ 41 , 42 ], unde au fost instruiți în modul în care să însoțească posturi și să-i sfătuiască cu privire la o dietă integrală pe bază de plante. Toți participanții vor fi chemați cu 1 până la 2 zile înainte și 1 zi după primele patru sesiuni de chimioterapie de către nutriționiștii studiului, pentru sfaturi și sprijin nutrițional. La fiecare apel telefonic, nutriționistul întreabă participanții și despre conformitatea lor cu intervenția alimentară printr-un interviu semi-structurat. Pe toată durata intervenției, participanții au opțiunea de a contacta medicul nutriționist prin e-mail sau telefon mobil în orice moment. Nutriționistul poate contacta investigatorul principal și echipa sa medicală pentru orice sfat medical necesar între orele 08:00–22:00 în fiecare zi, inclusiv în weekend.
Grup de post pe termen scurt
Metoda STF, așa cum este utilizată în intervenția noastră, își are originea într-o abordare bine stabilită a postului periodic (prelungit), care a fost implementată în Spitalul Immanuel din Berlin și în alte instituții de spitalizare și ambulatoriu din țările vorbitoare de limbă germană ( Germania, Austria, Elveția) de câteva decenii și se bazează în principal pe tehnica Buchinger; această abordare a postului a fost deja evaluată în studii clinice privind bolile reumatismale și afecțiunile dureroase cronice [ 43 , 44 ].
În primele patru cicluri de chimioterapie, participanții urmează un regim de post modificat de 60-72 de ore. Perioada de post începe cu 36-48 de ore înainte de fiecare ciclu de chimioterapie (la ora 18:00 cu 2 zile înainte de a primi chimioterapie) și se termină la 24 de ore după fiecare ciclu de chimioterapie. Participanții sunt sfătuiți să urmeze o dietă ușoară pe bază de plante înainte de post, cu un aport zilnic de energie de aproximativ 500-700 kcal (în a doua zi înainte de chimioterapie, de la micul dejun până la ora 18, când încep să postească). În toate perioadele de post, participanții au voie să consume doar sucuri de legume și bulion de legume, cu un aport maxim de energie alimentară de 350-400 kcal pe zi de post. Sunt permise cantități nerestricționate de apă și ceaiuri din plante. Pentru mai multe detalii despre informațiile exacte oferite pacienților din grupul de post, inclusiv rețete și momentul intervenției, vă rugăm să consultați Fișierul suplimentar 1 .
În cazurile în care participanții iau medicamente regulate pentru alte afecțiuni, este posibil ca medicamentele lor să fie ajustate în timpul zilelor de post, deoarece postul este cunoscut că poate reduce tensiunea arterială [ 45 ], influențează echilibrul electrolitic și influențează nivelul zahărului din sânge [ 46 , 47 ]. De asemenea, poate prelungi timpul de sângerare și poate declanșa atacuri de migrenă [ 44 ]. Din acest motiv, medicamentele diuretice, antihipertensive și antidiabetice, precum și cumarinele vor fi adaptate de către medici. Pacienții despre care se știe că suferă de migrene vor fi instruiți să-și ia medicamentele obișnuite, de îndată ce apar primele semne de migrenă în timpul postului. Pentru mai multe informații despre modificările necesare în medicația obișnuită în timpul STF, vă rugăm să consultați Fișierul suplimentar 2 .
Deoarece tratamentele cu Taxol pot fi săptămânale, participanții sunt sfătuiți să nu urmeze regimul STF în timpul acestor tratamente. În schimb, după ce au terminat primele patru cicluri de chimioterapie, toți participanții alocați intervenției de post sunt sfătuiți să urmeze doar dieta ușoară, pe bază de plante, descrisă mai sus, timp de două zile consecutive la fiecare aplicare Taxol. Aceasta înseamnă că cu o zi înainte și în ziua aplicării Taxol, participanților li se permite un aport caloric maxim de 1000 kcal. În plus, li se va sfătui să postească cel puțin 14 ore în noaptea dinaintea chimioterapiei Taxol.
Între toate întâlnirile cu chimioterapie, participanții sunt încurajați să urmeze o dietă lacto-vegetariană integrală. Pentru a ajuta la implementarea acestei diete, fiecărui participant i se dă o carte de bucate vegetariene, în plus față de fișe [ 48 ]. Dacă participanții îi indică nutriționistului că acest lucru nu este fezabil pentru ei, li se recomandă să mănânce maximum două porții de carne sau pește și două ouă pe săptămână. Astfel de abateri de la protocolul de bază sunt documentate de nutriționiști în timpul consilierii. Pentru mai multe informații privind consilierea nutrițională cu privire la recomandările date participanților la dieta vegetariană, vă rugăm să consultați Fișierul suplimentar 3 .
În această perioadă, participanții alocați intervenției de post sunt încurajați în plus să urmeze un model de alimentație cu restricții de timp, cu 14 ore de post peste noapte timp de cel puțin 6 zile pe săptămână.
Grup pe bază de plante
Participanții alocați acestui grup sunt instruiți să adere la o dietă normocalorică pe bază de plante cu alimente integrale, cu restricție de zahăr și carbohidrați rafinați. În primele patru cicluri de chimioterapie, pacienții mențin această dietă pe bază de plante pentru o durată de 60–72 ore, începând cu 36–48 ore înainte de începerea chimioterapiei și terminând cu 24 de ore după chimioterapie. După primele patru cicluri de chimioterapie, în timpul tratamentelor cu Taxol, aceștia ar trebui să mențină 2 zile de dietă pe bază de plante cu restricție de carbohidrați rafinați (24 ore înainte și după chimioterapie). Pentru informații mai detaliate despre această intervenție dietetică, vă rugăm să consultați Fișierul suplimentar 4 .
Pentru restul timpului de intervenție, acest grup este încurajat să urmeze dieta lacto-vegetariană integrală, așa cum este descrisă în secțiunea „ Grup de post pe termen scurt ”, precum și în Fișierul suplimentar 3 .
Monitorizarea datelor
Comitetul de monitorizare a datelor este format dintr-un medic, o asistentă de studiu și un expert în bioinformatică. Monitorizează îndeaproape toate programele vizitelor de studiu din toate centrele cooperante și rapoartele chestionarelor de la pacienți. Toate centrele cooperante au obligația de a raporta comitetului de monitorizare orice modificare a orelor vizitelor de studiu sau abateri de la protocolul de chimioterapie. În cazul oricărei încălcări a protocolului, comisia va raporta coordonatorului studiului. Comitetul de monitorizare a datelor este independent de sponsor și lipsit de interese concurente. Mai multe detalii despre procedurile sale de operare pot fi obținute contactând autorul corespunzător prin e-mail.
Evenimentele adverse sunt documentate la fiecare vizită, folosind elemente selectate în mod special din Criteriile comune de terminologie pentru evenimentele adverse ale Institutului Național al Cancerului, precum și întrebări deschise. Evenimentele adverse sunt, de asemenea, înregistrate în orice moment între vizite, atunci când un pacient raportează un astfel de eveniment personalului de studiu. Evenimentele adverse grave vor fi raportate coordonatorului studiului și investigatorului principal de îndată ce sunt cunoscute, într-un interval de timp de 24 de ore. Investigatorul principal poate, în strânsă colaborare cu comisia de monitorizare a datelor și coordonatorul studiului, să ia decizia de a întrerupe studiul, fie din cauza evenimentelor adverse sau grave atribuite intervenției studiului, fie din motivele menționate în „Criteriile de excludere ” secție sau din cauza eșecului de a recruta un număr suficient de pacienți. Nu vor avea loc analize intermediare, deoarece nu sunt de așteptat efecte dăunătoare asupra sănătății. Auditurile interne vor fi efectuate de către coordonatorul studiului, inclusiv toate centrele de studiu participante, la fiecare 6 luni. Toate centrele de studiu participante au obligația de a găzdui în mod regulat audituri externe, care sunt întreprinse de consiliile de certificare ale asociațiilor medicale responsabile [ 49 ].
Politici de difuzare a datelor
Rezultatele studiului vor fi publicate în reviste revizuite de colegi, iar participanții vor fi invitați la o prezentare publică a rezultatelor. La publicarea rezultatelor, datele anonime ale participanților individuali care stau la baza rezultatelor raportate, precum și codul statistic, vor fi puse la dispoziția investigatorilor științifici care emit o propunere solidă din punct de vedere metodologic. La nouă luni după publicarea rezultatelor noastre și cel puțin timp de 3 ani, datele vor fi depuse și disponibile la depozitul de date Charitè Universitiätsmedizin fără sprijinul investigatorului.
Măsuri finale
Pentru a evalua rezultatul primar (QOL legat de sănătate), folosim sistemul de măsurare Functional Assessment of Chronic Illness Therapy (FACIT©) [ 50 ], a cărui bază este Evaluarea Funcțională a Cancer Therapy-General (FACT-G©) . Scalele FACIT© servesc ca o completare a scalei FACT-G© prin acoperirea problemelor relevante legate de boală sau tratament care nu au fost deja abordate în chestionarul general (FACT-G©). Scala FACT-G© este evaluată electronic la momentul inițial și cu 2 zile înainte și 7 zile după fiecare ciclu de chimioterapie în chimioterapiile tri-săptămânale. De asemenea, se evaluează cu 2 zile înainte de chimioterapie și o dată la 7 zile după ultimul ciclu în chimioterapiile săptămânale, precum și la fiecare vizită de studiu. Pentru o prezentare generală a vizitelor, vă rugăm să consultați Tabelul 1 . Se va analiza modificarea rezumată a scorului FACT-G©.Tabelul 1 Prezentare generală a vizitei
Rezultatele secundare cuprind remisiile complete, determinate de numărul de remisii complete dovedite histologic (ypT0ypN0 sau ypT0/is) în specimenul chirurgical după chimioterapie neoadjuvantă. În acest specimen, se efectuează și o clasificare în funcție de scorul Miller și Payne și vor fi comparate rezultatele ambelor grupuri.
Alte măsuri de rezultat secundare sunt Trial Outcome Index, o măsurătoare a aspectelor fizice ale QOL, care constă din subscalele FACT-G© ale bunăstării fizice (PWB) și funcționale (FWB). Pentru preocupări suplimentare, am folosit alte scale specifice tumorii (FACT-B© pentru cancerul de sân, FACT-O© pentru cancerul ovarian) și specifice terapiei (FACT Taxane© și FACT-F©) FACIT©. O versiune modificată a Instrumentului de evaluare a neuropatiei periferice induse de chimioterapie (CIPNAT) [ 51 ], Scala de anxietate și depresie spitalicească (HADS) și elementele elective ale Criteriilor comune de terminologie pentru evenimentele adverse (CTCAE) [ 52 ] sunt alte măsuri secundare de rezultat. .
În plus, hemoleucograma completă (CBC) fără diferență este documentată la momentul inițial și la nadir (ziua 7, 8, 10 sau 11) (documentație standard conform ghidurilor Asociației Centrelor Germane de Tumori). La toate vizitele sunt înregistrate evenimentele adverse, măsurătorile antropometrice, tensiunea arterială și ritmul cardiac. La fiecare vizită, pacienții sunt rugați, de asemenea, să completeze un chestionar electronic despre comportamentul lor alimentar, efectele secundare ale chimioterapiei și calitatea vieții. Valorile sanguine ale ficatului (GPT, GOT, GGT, AP) și ale funcției renale (creatinină, uree) sunt măsurate într-o manieră specifică centrului.
Într-un subgrup ( n = 20), măsurătorile exploratorii ale IGF-1, insulinei și glicemiei vor fi efectuate în probe de sânge la momentul inițial, în ziua primei chimioterapii și la V1 (4 luni după momentul inițial). Mai mult, pentru a evalua complianța pacientului, corpii cetonici sunt măsurați în probe de sânge din vârful degetelor la momentul inițial și V1, precum și în timpul primelor patru cicluri de chimioterapie chiar înainte de administrarea chimioterapiei. Aceste probe de sânge sunt colectate de o asistentă sau de un medic calificat, analizate de laboratorul nostru universitar ca parametri de sânge de rutină și păstrate timp de câteva zile. Probele nu sunt depozitate pentru nicio utilizare ulterioară.
În subpopulația recrutată în centrul Freiburg (anticipat n = 10), se efectuează o măsurare neinvazivă a compoziției corporale în timpul primelor patru cicluri de chimioterapie în ziua chimioterapiei. Aceste măsurători sunt efectuate folosind analiza de impedanță bioelectrică.
Pentru măsurători exploratorii pe termen lung, cum ar fi frecvența recurenței tumorii sau incidența polineuropatiei și cardiomiopatiei, informațiile sunt preluate din dosarele pacientului, vizite și chestionare.
Conformitatea cu STF și regimul alimentar pe bază de plante este evaluată prin apeluri telefonice în jurul orei fiecăreia dintre primele patru întâlniri la chimioterapie. În plus, evaluăm conformitatea în chestionarele electronice care sunt completate periodic, înainte și după chimioterapii, precum și la 3 luni după terminarea chimioterapiei, printr-un chestionar electronic separat elaborat de grupul nostru. Chestionarele traduse pot fi găsite în Fișierul suplimentar 6 .
În plus, am realizat o evaluare calitativă sub forma unor interviuri focus-grup de 45 de minute [ 53 ] în care se evaluează acceptarea intervenției nutriționale respective, precum și implementarea intervenției, după chimioterapie cu 12 voluntari ( 6 din post și 6 din grupul pe bază de plante).
Pentru o prezentare detaliată a punctelor de timp pentru chestionare, consultați Tabelul 2 .Tabelul 2 Prezentare generală a chestionarului
Analiza datelor (dimensiunea eșantionului și analiză statistică)
Mărimea eșantionului a fost calculată utilizând un test Wilcoxon-Mann-Whitney pe 2 fețe. Dimensiunea eșantionului cu un grup de 67 de pacienți a jeun și un grup de 67 de pacienți pe bază de plante atinge o putere de 80% la un nivel de semnificație de p = 0,05 pentru a detecta o dimensiune a efectului de 0,5 pentru FACT-G© între aceste două grupuri. Dacă se presupune o rată suplimentară de abandon de 10%, avem nevoie de minim 148 de pacienți. Cu un raport de 4:1 între pacienții cu cancer de sân și cancer ovarian, avem nevoie de un total de 150 de pacienți (120 de pacienți cu cancer de sân și 30 de pacienți de cancer ovarian), împărțiți în 75 de pacienți fiecare (60 de pacienți cu cancer de sân și 15 de pacienți de cancer ovarian) pentru Grupul STF și grupul pe bază de plante. Toate scalele FACIT© sunt proiectate cu un scor mai mare care indică o bunăstare mai bună. În consecință, am inversat scorurile de răspuns la întrebările formulate negativ. Scorurile vor fi obținute în conformitate cu formula care a fost stabilită anterior de sistemul FACIT©. În cazurile în care întrebările individuale sunt omise, scorurile vor fi calculate proporțional utilizând media celorlalte răspunsuri din subscale (scorul subscalei proporțional = [suma scorurilor itemilor] × [ N de itemi din subscală]/[ N de itemi la care s-a răspuns]) atâta timp cât se răspunde la peste 50% din itemi (minim 4 itemi pentru subscale). Scorul FACT-G este considerat adecvat atâta timp cât cel puțin 22 din 27 de itemi FACT-G sunt completați (≥ 80%). Corelațiile inter-subscale vor fi calculate folosind corelația Pearson, iar fiabilitatea consistenței interne pentru toate scalele va fi evaluată prin calculul alfa lui Cronbach. Când alfa lui Cronbach a depășit 0,90, scala este considerată a avea suficientă precizie pentru clasificarea sau diagnosticul individual. Diferențele minime importante (MID) dintre STF și grupurile pe bază de plante, adică „cea mai mică schimbare a scorului pe care pacienții o percep ca fiind importantă, fie benefică, fie dăunătoare, și care l-ar determina pe clinician să ia în considerare o schimbare în managementul pacientului” va fi folosit pentru a găsi îmbunătățiri semnificative clinic [ 54]. Valorile MID peste 3–7 (media 5) pentru FACT-G© și peste 3–4 pentru subscala de oboseală și 6 pentru totalul FACT-F vor fi considerate semnificative. Normalitatea va fi testată cu testul Shapiro-Wilks. În plus, vor fi aplicate diverse metode de ajustare în etapa de analiză statistică. Vom folosi „analiza scorului de modificare” care determină efectul de grup, pe baza diferenței dintre scorul de bază și post-tratament (ajustare de bază) și analiza covarianței. Aceasta este o ajustare bazată pe model care include linia de bază a variabilei de rezultat în model. Ajustarea statistică poate fi efectuată și prin utilizarea regresiei logistice sau prin punerea în comun a analizelor stratificate, folosind, de exemplu, un test Mantel-Haenszel. Vom folosi simultan aceste diferite metode de proiectare care reduc dezechilibrul covariatelor și ajustarea statistică în timpul analizei. Analiza statistică va fi efectuată folosind R versiunea 3.5.1 (R Foundation) și IBM SPSS Statistics, versiunea 26.0 (IBM Corp., Armonk, NY, SUA).
Discuţie
Acesta este primul studiu clinic randomizat controlat care evaluează efectele postului intermitent pe termen scurt în timpul chimioterapiei asupra QOL și, într-o subpopulație, asupra remisiunii tumorii histologice. Este, de asemenea, primul studiu care compară efectele STF intermitent cu o dietă intermitentă pe termen scurt pe bază de plante într-un astfel de cadru.
Puncte forte
Unul dintre principalele puncte forte ale acestui studiu este dimensiunea mare a eșantionului, necaracteristică pentru o abordare inovatoare și neobișnuită de intervenție alimentară în oncologie. Din cunoștințele noastre, acesta este cel mai mare studiu de confirmare privind intervențiile dietetice care implică postul în contextul chimioterapiei. De asemenea, designul studiului randomizat controlat se adaugă la această putere. Faptul că chestionarele inițiale sunt completate de către pacienți înainte de alocarea intervențională ar putea compensa efectele placebo la momentul inițial. Un alt punct forte al acestui studiu este că se concentrează atât pe datele histologice, cât și pe multiple rezultate legate de pacient, cum ar fi oboseala și calitatea vieții. Acest lucru va oferi o perspectivă profundă asupra efectelor fizice și psihologice ale ambelor intervenții alimentare asupra pacienților. În plus, ca urmare a monitorizării electronice strânse a rezultatelor, ne așteptăm la seturi de date destul de complete. De asemenea, pe lângă măsurătorile de rutină de laborator, investigăm markeri moleculari exploratori, cum ar fi IGF-1, într-o subpopulație. Aceste date ne vor permite să explorăm în continuare mecanismele STF intermitent și efectele unei diete intermitente pe termen scurt pe bază de plante care însoțește chimioterapia, pentru a crea o bază pentru opțiuni de tratament ulterioare. În cele din urmă, acesta este primul studiu de intervenție care examinează dacă un efect benefic asupra sănătății rezultă doar din post sau dacă ar putea fi obținut și printr-o dietă pe bază de plante cu restricție a aportului de carbohidrați rafinați.
Limitări
O intervenție alimentară ca adjuvant la chimioterapie este o modalitate ușoară și rentabilă de a îmbunătăți tratamentul necesar, dacă are succes. Cu toate acestea, efectuarea unui studiu controlat asupra unei intervenții alimentare a cunoscut provocări, deoarece orbirea și controlul placebo nu sunt posibile și, prin urmare, efectele nespecifice nu pot fi excluse. În plus, aderarea la o intervenție alimentară este dificil de evaluat în mod obiectiv. Această dificultate este prezentă în mod specific în studiul nostru, din cauza ambulatoriului și a duratei relativ lungi de studiu. Chiar dacă urmărim respectarea dietei prin diferite metode (chestionare, apeluri telefonice de la nutriționiști, vizite de studiu) și tot personalul studiului este instruit pentru a încuraja pacienții să dezvăluie cu onestitate toate alimentele și băuturile consumate în timpul perioadelor STF sau a dietei pe bază de plante, acest lucru nu poate exclude posibilitatea de raportare insuficientă sau greșită.
Întrucât curele de post se bucură de o popularitate ridicată în Germania, un grup de control pe lista de așteptare care nu a suferit nicio modificare alimentară era puțin probabil să funcționeze. Totuși, dezamăgirea față de alocarea dietetică intervențională ar putea determina unii pacienți alocați grupului de control să urmeze intervenția STF fără a informa personalul studiului. În studiul nostru pilot [ 12 ], unii dintre participanții care au fost alocați grupului STF pentru prima dată nu au întrerupt postul când li s-a cerut, din cauza designului crossover, să oprească STF. Ei au susținut că au simțit că STF și-a îmbunătățit starea de sănătate în așa fel încât nu mai doreau să adere la protocolul de studiu. Pentru a preveni astfel de încălcări ale protocolului din cauza preferințelor individuale, am proiectat acest studiu cu o intervenție de control alimentară presupus eficientă ca comparator [ 33 ]. După cum se arată în secțiunea introductivă a acestei publicații, o combinație de restricție calorică ușoară cu o restricție puternică de proteine a avut unele efecte de imitare a postului la șoareci [ 35 , 55 ]. Pentru proiectarea acestui studiu, am postulat că o restricție ușoară de proteine ar putea, de asemenea, să sporească tratamentul convențional și să reducă efectele secundare, dar nu în aceeași măsură ca STF. Intervenția de control selectată poate reduce și dilua diferențele dintre grupuri, dacă efectul restricției de proteine și zahăr se apropie de efectul „adevărat” STF. Deci, din motive fezabile, reducerea abandonului după randomizare și îmbunătățirea conformității participanților, am proiectat intervenția de control așa cum este descris, acceptând riscul ca efectele STF în sine să nu mai fie detectabile atunci când grupurile sunt comparate. Dacă acesta ar fi cazul, vom lua în considerare compararea rezultatelor cohortei noastre cu rezultatele cohortelor similare tratate convențional, publicate în altă parte.
O altă limitare a acestui studiu este cadrul multicentric. Desigur, este și un punct forte major, deoarece efectele specifice centrului pot fi diluate și pot fi trase concluzii mai generale. Dar, deși un proces de certificare pentru centrele specializate pentru cancerul de sân din Germania există [ 49 ], procedurile din realitatea clinică pot varia substanțial. Unele dintre centrele participante efectuează doar partea chirurgicală a tratamentului și externalizează chimioterapiile către diferite centre de ambulatoriu. Alte centre efectuează ele însele toate procedurile relevante, de la intervenții chirurgicale la chimioterapie și intervenții de urmărire, inclusiv radioterapia. Acest lucru creează o diversitate de setări, în care se aplică chimioterapia. Este o provocare să stabilim proceduri standard de operare în fiecare dintre aceste setări.
Una dintre problemele adaptării procedurilor existente la cerințele noastre poate fi exemplificată prin aplicațiile coterapeutice ale perfuziilor cu cortizon. Teoretic, infuziile de cortizon ar contracara efectul ambelor intervenții alimentare, deoarece cortizonul acționează direct asupra căii IGF-1. Dar în toate centrele cooperante, perfuziile cu cortizon aparțin îngrijirii standard și nu pot fi adaptate în scopul acestui studiu din motive practice.
Datele preclinice și studiile clinice existente privind postul pe termen scurt și restricția proteică sunt promițătoare. Astfel, studiul FIT2 are potențialul de a furniza date esențiale privind efectele și eficacitatea postului intermitent de scurtă durată și a unei diete intermitente pe termen scurt pe bază de plante la pacienții cu carcinom ovarian sau mamare în timpul chimioterapiei. Luată împreună, această abordare va ajuta la furnizarea de predicții mai clare și mai bine informate cu privire la siguranța și eficacitatea unor astfel de intervenții alimentare care însoțesc abordările convenționale.
Starea de recrutare
În prezent, acest studiu recrutează pacienți.
Disponibilitatea datelor și materialelor
Toate datele relevante sunt disponibile în suplimente. Pentru orice întrebări suplimentare, vă rugăm să contactați autorul corespunzător.
Abrevieri
Akt:
Protein kinaza BCIPNAT:
Instrument de evaluare a neuropatiei periferice induse de chimioterapieCTCAE:
Criterii comune de terminologie pentru evenimente adverseDSR:
Rezistență diferențială la stresFAPT Taxan:
Evaluarea funcțională a terapiei cancerului-TaxanFAPT/FACT:
Evaluarea funcțională a terapiei bolilor croniceFACT-B:
Evaluarea Funcțională a Terapiei Cancerului-Cancerul de sânFACT-F:
Evaluarea Funcțională a Terapiei Cancerului-ObosealăFACT-G:
Evaluarea funcțională a terapiei cancerului-generalFACT-O:
Evaluarea Funcțională a Terapiei Cancerului-Cancer ovarianFWB:
Bunăstare funcționalăARE:
Scala de anxietate și depresie a spitaluluiICH-GCP:
Conferința internațională privind armonizarea bunei practici cliniceIGF-1:
Factorul de creștere asemănător insulinei 1mTOR:
Ținta rapamicinei la mamiferePWB:
Sanatate fizicaQOL:
Calitatea viețiiROS:
Specii reactive de oxigenSTF:
Post de scurtă durată
Referințe
- Fontana L, Partridge L, Longo VD. Extinderea duratei de viață sănătoase – de la drojdie la oameni. Ştiinţă. 2010;328(5976):321–6.Articol CAS PubMed PubMed Central Google Academic
- Mair W, Dillin A. Îmbătrânirea și supraviețuirea: genetica extinderii duratei de viață prin restricție alimentară. Annu Rev Biochem. 2008;77:727–54.Articol CAS PubMed Google Academic
- Antoni R, Johnston KL, Collins AL, Robertson MD. Efectele postului intermitent asupra metabolismului glucozei și lipidelor. Proc Nutr Soc. 2017;76(3):361–8.Articol CAS PubMed Google Academic
- Longo VD, Mattson MP. Postul: mecanisme moleculare și aplicații clinice. Cell Metab. 2014;19(2):181–92.Articol CAS PubMed PubMed Central Google Academic
- Michalsen A, Schneider S, Rodenbeck A, Ludtke R, Huether G, Dobos GJ. Efectele pe termen scurt ale postului asupra sistemului neuroendocrin la pacienții cu sindroame dureroase cronice. Nutr Neurosci. 2003;6(1):11–8.Articol CAS PubMed Google Academic
- Michalsen A, Li C, Kaiser K, Ludtke R, Meier L, Stange R, et al. Tratamentul fibromialgiei în spital: o comparație controlată nerandomizată a medicinei convenționale versus medicina integrativă, inclusiv terapia de post. Evid Based Complement Alternat Med. 2013;2013:908610.Articol PubMed PubMed Central Google Academic
- Choi IY, Piccio L, Childress P, Bollman B, Ghosh A, Brandhorst S și colab. O dietă care imită postul promovează regenerarea și reduce autoimunitatea și simptomele sclerozei multiple. Cell Rep. 2016;15(10):2136–46.Articol CAS PubMed PubMed Central Google Academic
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Restricția calorică întârzie debutul bolii și mortalitatea la maimuțele rhesus. Ştiinţă. 2009;325(5937):201–4.Articol CAS PubMed PubMed Central Google Academic
- Antunes F, Erustes AG, Costa AJ, Nascimento AC, Bincoletto C, Ureshino RP, et al. Autofagia și postul intermitent: legătura pentru terapia cancerului? Clinici (Sao Paulo). 2018;73(suppl 1):e814s.Articol Google Academic
- Dorff TB, Groshen S, Garcia A, Shah M, Tsao-Wei D, Pham H și colab. Siguranța și fezabilitatea postului în combinație cu chimioterapia pe bază de platină. BMC Cancer. 2016;16:360.Articol PubMed PubMed Central CAS Google Academic
- de Groot S, Vreeswijk MP, Welters MJ, Gravesteijn G, Boei JJ, Jochems A, et al. Efectele postului pe termen scurt asupra toleranței la chimioterapia (neo)adjuvantă la pacienții cu cancer de sân HER2 negativ: un studiu pilot randomizat. BMC Cancer. 2015;15:652.Articol PubMed PubMed Central CAS Google Academic
- Bauersfeld SP, Kessler CS, Wischnewsky M, Jaensch A, Steckhan N, Stange R și colab. Efectele postului pe termen scurt asupra calității vieții și toleranței la chimioterapie la pacienții cu cancer de sân și ovarian: un studiu pilot randomizat încrucișat. BMC Cancer. 2018;18(1):476.Articol PubMed PubMed Central CAS Google Academic
- Chan A, Abdullah MM, Ishak W, Ong-Cornel AB, Villalon AH, Kanesvaran R. Aplicabilitatea National Comprehensive Cancer Network/Multinational Association of Supportive Care in Cancer Guidelines for Prevention and Management of Chemotherapy-Induced Greatest and vomiting in Southeast Asia : o declarație de consens. J Glob Oncol. 2017;3(6):801–13.Articol PubMed Google Academic
- Navari RM, Aapro M. Profilaxia antiemetică pentru greața și vărsăturile induse de chimioterapie. N Engl J Med. 2016;374(14):1356–67.Articol CAS PubMed Google Academic
- Cave J, Paschalis A, Huang CY, West M, Copson E, Jack S și colab. O revizuire sistematică a siguranței și eficacității exercițiilor aerobe în timpul tratamentului cu chimioterapie citotoxică. Suport Care Cancer. 2018;26(10):3337–51.Articol CAS PubMed Google Academic
- Duregon F, Vendramin B, Bullo V, Gobbo S, Cugusi L, Di Blasio A, et al. Efectele exercițiilor fizice asupra pacienților cu cancer care suferă de neuropatie periferică indusă de chimioterapie în curs de tratament: o revizuire sistematică. Crit Rev Oncol Hematol. 2018;121:90–100.Articol PubMed Google Academic
- Nurgali K, Jagoe RT, Abalo R. Editorial: Efecte adverse ale chimioterapiei cancerului: ceva nou pentru a îmbunătăți toleranța și a reduce sechelele? Front Pharmacol. 2018;9:245.Articol PubMed PubMed Central CAS Google Academic
- Lee C, Raffaghello L, Brandhorst S, Safdie FM, Bianchi G, Martin-Montalvo A, et al. Ciclurile de post întârzie creșterea tumorilor și sensibilizează o serie de tipuri de celule canceroase la chimioterapie. Sci Transl Med. 2012;4(124):124ra27.Articol PubMed PubMed Central Google Academic
- Raffaghello L, Lee C, Safdie FM, Wei M, Madia F, Bianchi G, et al. Rezistența diferențială la stres dependentă de foame protejează celulele normale, dar nu și canceroase, împotriva chimioterapiei cu doze mari. Proc Natl Acad Sci US A. 2008;105(24):8215–20.Articol CAS PubMed PubMed Central Google Academic
- Lee C, Longo VD. Postul vs restricția alimentară în protecția celulară și tratamentul cancerului: de la organisme model la pacienți. Oncogene. 2011;30(30):3305–16.Articol CAS PubMed Google Academic
- Lee C, Safdie FM, Raffaghello L, Wei M, Madia F, Parrella E, et al. Nivelurile reduse de IGF-I mediază protecția diferențială a celulelor normale și canceroase ca răspuns la post și îmbunătățesc indicele chimioterapeutic. Cancer Res. 2010;70(4):1564–72.Articol CAS PubMed PubMed Central Google Academic
- Nencioni A, Caffa I, Cortellino S, Longo VD. Postul și cancerul: mecanisme moleculare și aplicare clinică. Nat Rev Cancer. 2018;18(11):707–19.Articol CAS PubMed PubMed Central Google Academic
- Michalsen A, Kuhlmann MK, Ludtke R, Backer M, Langhorst J, Dobos GJ. Postul prelungit la pacienții cu sindroame dureroase cronice duce la o îmbunătățire tardivă a dispoziției, care nu este legată de pierderea în greutate și de epuizarea leptinei indusă de post. Nutr Neurosci. 2006;9(5–6):195–200.Articol CAS PubMed Google Academic
- Bruera E. ABC al îngrijirilor paliative. Anorexie, cașexie și nutriție. BMJ. 1997;315(7117):1219–22.Articol CAS PubMed PubMed Central Google Academic
- Shike M. Terapie de nutriție pentru bolnavul de cancer. Hematol Oncol Clin North Am. 1996;10(1):221–34.Articol CAS PubMed Google Academic
- O’Flanagan CH, Smith LA, McDonell SB, Hursting SD. Când mai puțin poate fi mai mult: restricția calorică și răspunsul la terapia cancerului. BMC Med. 2017;15(1):106.Articol PubMed PubMed Central CAS Google Academic
- Safdie FM, Dorff T, Quinn D, Fontana L, Wei M, Lee C și colab. Postul și tratamentul cancerului la oameni: un raport de serie de cazuri. Îmbătrânire (Albany NY). 2009;1(12):988–1007.Articol Google Academic
- Schupp M, Chen F, Briggs ER, Rao S, Pelzmann HJ, Pessentheiner AR și colab. Analiza metaboliților și a transcriptomului în timpul postului sugerează un rol pentru axa p53-Ddit4 în țesuturile metabolice majore. BMC Genomics. 2013;14:758.Articol PubMed PubMed Central CAS Google Academic
- Zeng X, Yan T, Schupp JE, Seo Y, Kinsella TJ. Repararea nepotrivirii ADN inițiază autofagia indusă de 6-tioguanină prin activarea p53 în celulele tumorale umane. Clin Cancer Res. 2007;13(4):1315–21.Articol CAS PubMed Google Academic
- Colbert LH, Westerlind KC, Perkins SN, Haines DC, Berrigan D, Donehower LA, et al. Efectele exercițiului asupra tumorigenezei într-un model de șoarece cu deficit de p53 de cancer de sân. Med Sci Sports Exercice. 2009;41(8):1597–605.Articol CAS PubMed PubMed Central Google Academic
- Sonntag WE, Lynch CD, Cefalu WT, Ingram RL, Bennett SA, Thornton PL, et al. Efectele pleiotrope ale hormonului de creștere și ale factorului de creștere asemănător insulinei (IGF)-1 asupra îmbătrânirii biologice: inferențe de la animale cu restricții calorice moderate. J Gerontol A Biol Sci Med Sci. 1999;54(12):B521–38.Articol CAS PubMed Google Academic
- Spindler SR. Restricție calorică: de la supă la nuci. Aging Res Rev. 2010;9(3):324–53.Articol CAS PubMed Google Academic
- Mauro CR, Tao M, Yu P, Trevino-Villerreal JH, Longchamp A, Kristal BS și colab. Restricția alimentară preoperatorie reduce hiperplazia intimală și protejează de leziunile de ischemie-reperfuzie. J Vasc Surg. 2016;63(2):500–9.e1.Articol PubMed Google Academic
- Allen NE, Key TJ, Appleby PN, Travis RC, Roddam AW, Tjonneland A și colab. Alimentele de origine animală, proteinele, calciul și riscul de cancer de prostată: investigația europeană prospectivă asupra cancerului și nutriției. Br J Cancer. 2008;98(9):1574–81.Articol CAS PubMed PubMed Central Google Academic
- Robertson LT, Trevino-Villarreal JH, Mejia P, Grondin Y, Harputlugil E, Hine C, et al. Restricția de proteine și calorii contribuie suplimentar la protecția împotriva leziunii de reperfuzie a ischemiei renale, parțial prin reducerea leptinei la șoarecii masculi. J Nutr. 2015;145(8):1717–27.Articol CAS PubMed PubMed Central Google Academic
- RStudio SS. https://www.rstudio.com/products/shiny/shiny-server/ 2018. Accesat la 11 septembrie 2020.
- Sparano JA, Wang M, Martino S, Jones V, Perez EA, Saphner T și colab. Paclitaxel săptămânal în tratamentul adjuvant al cancerului de sân. N Engl J Med. 2008;358(16):1663–71.Articol CAS PubMed PubMed Central Google Academic
- Henderson IC, Berry DA, Demetri GD, Cirrincione CT, Goldstein LJ, Martino S și colab. Rezultate îmbunătățite din adăugarea de paclitaxel secvențial, dar nu și din creșterea dozei de doxorubicină într-un regim de chimioterapie adjuvantă pentru pacienții cu cancer de sân primar cu ganglioni pozitivi. J Clin Oncol. 2003;21(6):976–83.Articol CAS PubMed Google Academic
- Boyd LR, Muggia FM. Inducerea carboplatinei/paclitaxelului în cancerul ovarian: punctele fine. Oncologie (Williston Park). 2018;32(8):418–20 22-4.Google Academic
- Lee MX, Tan DS. Paclitaxel săptămânal comparativ cu 3 săptămâni în combinație cu carboplatin în cancerul ovarian avansat: care este regimul optim de chimioterapie adjuvantă? J Gynecol Oncol. 2018;29(6):e96.Articol CAS PubMed PubMed Central Google Academic
- Fastenakademie DD. https://www.fastenakademie.de/die-dfa 2016. Accesat la 11 septembrie 2020.
- Gesundheitsberatung UU. https://www.ugb.de/ 2019. Accesat la 11 septembrie 2020.
- Michalsen A, Li C. Terapia de post pentru tratarea și prevenirea bolilor – starea actuală a dovezilor. Forsch Komplementmed. 2013;20(6):444–53.Articol PubMed Google Academic
- Wilhelmi de Toledo F, Grundler F, Bergouignan A, Drinda S, Michalsen A. Siguranța, îmbunătățirea sănătății și bunăstarea în timpul unei perioade de post de 4 până la 21 de zile într-un studiu observațional care a inclus 1422 de subiecți. Plus unu. 2019;14(1):e0209353.Articol CAS PubMed PubMed Central Google Academic
- Li C, Ostermann T, Hardt M, Ludtke R, Broecker-Preuss M, Dobos G și colab. Răspunsul metabolic și psihologic la postul de 7 zile la pacienții obezi cu și fără sindrom metabolic. Forsch Komplementmed. 2013;20(6):413–20.Articol PubMed Google Academic
- Wilhelmi de Toledo F, Buchinger A, Burggrabe H, Holz G, Kuhn C, Lischka E, et al. Terapia cu post – o actualizare a grupului de experți a ghidurilor de consens din 2002. Forsch Komplementmed. 2013;20(6):434–43.Articol PubMed Google Academic
- Stange R, Pflugbeil C, Michalsen A, Uehleke B. Postul terapeutic la pacienții cu sindrom metabolic și rezistență la insulină afectată. Forsch Komplementmed. 2013;20(6):421–6.Articol PubMed Google Academic
- Bosmann S, Paul A. Vegetarisch vollwertig kochen. NATUR UND MEDIZIN KVC Verlag; 2015.
- Krebsgesellschaft eVD. https://www.krebsgesellschaft.de/deutsche-krebsgesellschaft/zertifizierung.html 2018. Accesat la 11 septembrie 2020.
- http://www.facit.org. https://www.facit.org/FACITOrg/Questionnaires 2010. Accesat la 11 septembrie 2020.
- Tofthagen CS, McMillan SC, Kip KE. Dezvoltarea și evaluarea psihommetrică a instrumentului de evaluare a neuropatiei periferice induse de chimioterapie. Asistente de cancer. 2011;34(4):E10–20.Articol PubMed Google Academic
- Trotti A, Colevas AD, Setser A, Rusch V, Jaques D, Budach V, et al. CTCAE v3.0: dezvoltarea unui sistem cuprinzător de clasificare a efectelor adverse ale tratamentului cancerului. Semin Radiat Oncol. 2003;13(3):176–81.Articol PubMed Google Academic
- Wong LP. Discuție focus grup: un instrument pentru sănătate și cercetare medicală. Singap Med J. 2008;49(3):256–60 quiz 61.CAS Google Academic
- Schunemann HJ, Akl EA, Guyatt GH. Interpretarea rezultatelor măsurilor de rezultat raportate de pacient în studiile clinice: perspectiva clinicianului. Rezultate de viață de calitate în sănătate. 2006;4:62.Articol PubMed PubMed Central Google Academic
- Jongbloed F, Saat TC, Verweij M, Payan-Gomez C, Hoeijmakers JH, van den Engel S, et al. O semnătură a rezistenței la stres renal indusă de restricția alimentară pe termen scurt, post și restricția de proteine. Sci Rep. 2017;7:40901.Articol CAS PubMed PubMed Central Google Academic
Mulțumiri
Mulțumim Miriam Rösner, care, în calitate de asistent medical de studiu, a ajutat la traducerea designului studiului într-un protocol practic, și Alexandrei Prüß, care cu expertiza ei ca nutriționist a contribuit la redactarea și formatarea documentelor pentru pacienți.
Finanțarea
Acest studiu este finanțat de un sponsor privat (G. Müller, Munchen, Germania) și un grant de la Fundația Günter și Regine Kelm (Zurich, Elveția). Organismele de finanțare nu au avut niciun rol în proiectarea studiului; colectarea, analiza și interpretarea datelor; sau scrierea manuscrisului. Finanțare cu acces deschis oferită de Projekt DEAL.
Informatia autorului
Autori și afilieri
- Institutul de Medicină Socială, Epidemiologie și Economie a Sănătății, Charité – Universitätsmedizin Berlin, membru corporativ al Freie Universität Berlin, Humboldt-Universität zu Berlin și Institutul de Sănătate din Berlin, Berlin, GermaniaDaniela Koppold-Liebscher, Christian S. Kessler, Nico Steckhan, Vanessa Bähr, Marisa Hübner, Barbara Kunz, Michael Jeitler, Rainer Stange și Andreas Michalsen
- Departamentul de Medicină Internă și Integrativă, Spitalul Immanuel Berlin, Berlin, GermaniaChristian S. Kessler, Marisa Hübner, Michael Jeitler și Andreas Michalsen
- Departamentul de Ginecologie, Spitalul Waldfriede, Berlin, GermaniaCornelia Kempter
- Departamentul de Matematică și Informatică, Universitatea din Bremen, Bremen, GermaniaManfred Wischnewsky
- Centrul de sân al Spitalului Vivantes, Berlin, GermaniaMarion Paul
- Departamentul de Medicină I, Secția Nutriție Clinică și Dietetică, Centrul Medical – Universitatea din Freiburg, Freiburg im Breisgau, GermaniaStefanie Zorn
- Departamentul de Nutriție, Technische Universität München, München, GermaniaSophia Sari
Contribuții
Andreas Michalsen, Christian S. Kessler, Daniela Koppold-Liebscher, Rainer Stange, Michael Jeitler, Cornelia Kempter și Marion Paul au conceput partea clinică a studiului. Stefanie Zorn (substudiu Freiburg), Manfred Wischnewsky (statistici), Nico Steckhan (bioinformatică), Vanessa Bähr (monitorizare), Barbara Kunz (planuri nutriționale) și Sophia Sari (evaluarea conformității) au conceput aplicația detaliată în domeniile lor de expertiză. . Sophia Sari și Daniela Liebscher au scris manuscrisul principal. Barbara Kunz (planuri nutriționale), Manfred Wischnewsky (statistici) și Marisa Hübner (traducerea planurilor nutriționale și a tuturor celorlalte suplimente, precum și aprobarea etică) au contribuit semnificativ la conținut. Toți autorii au citit, editat, rafinat și aprobat manuscrisul. Toți autorii și-au dat acordul pentru publicarea acestei lucrări.
autorul corespunzator
Declarații de etică
Aprobarea etică și acordul de participare
O traducere în limba engleză a aprobării de etică a fost depusă alături de lucrare. Este a treia și ultima versiune de protocol. Această versiune modificată a protocolului a fost revizuită și aprobată de comitetul de etică al Charité Universitätsmedizin Berlin (Charitéplatz 1, 10117 Berlin) în iulie 2018, urmată de consiliile de evaluare etică ale Albert-Ludwigs-Universität Freiburg (Engelberger Strasse 21, 7906 Freiburg) în octombrie 2018 și al asociației medicale din Baden-Württemberg (Landesärztekammer Baden-Württemberg, Postfach 700361, 70573 Stuttgart) în decembrie 2018. Protocolul original a fost revizuit și aprobat de comitetul de etică al Charité Universitäts2medizin6 din Berlin.
Consimțământ pentru publicare
Nu se aplică
Interese concurente
Autorii nu declară interese concurente. Sponsorii studiului nu sunt implicați în proiectarea, interpretarea sau publicarea datelor.
Informații suplimentare
Nota editorului
Springer Nature rămâne neutră în ceea ce privește revendicările jurisdicționale din hărțile publicate și afilierile instituționale.
Informatie suplimentara
Fișierul suplimentar 1 din Postul pe termen scurt însoțit de chimioterapia ca terapie de susținere în cancerul ginecologic: protocol pentru un studiu clinic controlat randomizat multicentricSăriți la fig share navigare
Protocol pentru post însoțit de chimioterapie(CT)1-a 4-a chimioterapieAzi cu aplanta usoara-dieta bazata, încare proteine, grăsimi și carbohidrați absorbibili rapidnu sunt recomandate (vezi planul de mese),urmează să fie efectuată înainte de începereapostperioadăiar la capătul ei.Postul începe seara zilei cu planta ușoară-dieta bazata la ora 18 si se terminaLa 24 de ore de la terminarea perfuziilor medicamentoase. Ziua 1Ziua 2Ziua 3Ziua 4Ziua 5Început: 2 zile înainte de CT1 ziînainte de CTziua CT1 zidupa CTSfârşitPlanta usoara-dieta bazata18:00 începede postpostpostpostpana la 24hdupă sfârșitde CTPlanta usoara-dieta bazata*Planta usoara-dieta bazata**până la 24 ore după încheierea postuluiDe la a 5-a chimioterapie încoaceAici vă recomandămAușoarăplantă-dieta bazatacu o zi înainte și în ziua chimioterapiei.Între cele două zile un 14hintermitentpostul este de făcut, adicăsă nu mănânceoricede la ora 18.00 cu o zi înainte de chimioterapie până la ora 8 dinziua chimioterapiei,în timp ce beapmulte calorii-băuturi gratuite.Ziua 1Zi2Dda inainte de CTDay de CTPlanta usoara-bazatcura de slabireora 18.00 începutulpost8 amcapăt depostPlanta usoara-bazatcura de slabireIntrechimioterapiiIntrechimioterapiiva recomandam sa urmatio dietă vegetariană cu alimente integrale (vezisepfişa de recomandare arate) în combinaţie cu a14hintermitentpostregim.Acesta ar putea fi după cum urmează: mănânci până la ora 18, apoi încetezi să mănânci în timp ce consumi din belșugde calorii-băuturi gratuite și puteți sa mânca din nou la 8 dimineața Sau poți sări peste unamasa (mic dejun sau cina). Vă recomandăm să urmați regimul de post intermitent de 14 orecel puțin șase zile pe săptămână.
Light plant
–
based diet
The
l
ight plant
–
based diet
day facilitates circulation and digestion and prepares the body for the fast.
You should for this purpose
reduce your
diet to
certain
foods
(organic
vegetables
are very suitable)
,
prepared
without additional fat, protein
s
or sweetener
s
. On such a day you
should try to
consume at
least two litres of mineral water or unsweetened herbal tea.
Here you will find some suggestions of for your meals during such a light plant
–
based diet day.
Examples of a meal plan
for a light plant
–
based diet
Rice day
Three
times daily 50
g whole grain basmati rice, 50
g millet or 50
g quinoa cooked in
100
ml water
until soft
. In the morning served with 200
g berries
or
150
g freshly
grated unpee
led apple, for lunch and dinner with 200
g steamed tomatoes or other
vegetables,
fresh herbs (parsley or basil) and if needed a
little
salt for the taste.
Potato day
600
–
700g
low
–
starch
cooked potatoes to be distributed t
o 3 meals. The potatoes
should
be prepared as potatoes in the skin or oven pota
toes (e.g. with fresh herbs
such
as marjoram, parsley, thyme, chives, dill or caraway). These are served with
approximately
200
g vegetables
per meal
, e.g. f
or breakfast
with fresh tomatoes
topped with chives, lemon and curry
powder, for lunch and dinner with steamed
veget
ables and fresh
herbs
. I
f needed
, add
a
little
salt.
Oat day
Three times daily 50
g rolled wholegrain oats, soaked shortly in water
and
served
with 200
g
of
berries o
r
150
g freshly grated unpee
led apple with cinnamon and pure
vanilla powder. Alternatively
serve
with
200
g
of
steamed vegetables and fresh herbs
.
Add some
salt, if needed.
Vegetable day
Breakfast:
Mix
200
g
of
grated carrot
s
and one medium size grated apple with some
lemon juice, cinnamon or pure vanilla powder (optionally
add
1 tsp olive
–
or linseed
oil)
Lunch:
e.g. 200
g steamed cauliflower and 100
g steamed brocc
oli or 200
g steamed
pumpkin and 100
g steamed kohlrabi with one medium size
low
–
starch
potato. If well
tolerated a salad can be prepared alternatively with 50g leaf
y greens (e.g. chicoree,
iceberg or lamb’s lettuce), 1 medium size tomato, 6 radishes, one quater cucumber
with fresh herbs, lemon juice, white pepper, a little bit of sea salt and if needed 1 tsp
olive
–
or linseed oil.
Alternatively you can prepare a sal
ad instead of steamed vegetables. This could
consist of 50 g leaf lettuce (e.g. chicory, iceberg lettuce,
mache), 1 medium size
tomato, 6 small radishes, a quarter of a green cucumber with lemon juice, fresh herbs,
white pepper and a little salt. If necess
ary, add a tsp of olive
–
or linseed oil.
Dinner
: steamed vegetables as recommended for lunch1/6Descarcacota de smochinFișier suplimentar 1Fișier suplimentar 1. Fișe pentru grupul de post.
Fișier suplimentar 1.
Fișe pentru grupul de post.
Fișier suplimentar 2.
Proceduri operaționale standard pentru adaptarea medicamentelor în timpul postului.
Fișier suplimentar 3.
Fișă despre dieta vegetariană integrală.
Fișier suplimentar 4.
Fișe pentru dieta integrală pe bază de plante normocalorică.
Fișier suplimentar 5.
Formular de consimțământ informat.
Fișier suplimentar 6.
Chestionare traduse.
Drepturi și permisiuni
Acces deschis Acest articol este licențiat în baza unei licențe internaționale Creative Commons Attribution 4.0, care permite utilizarea, partajarea, adaptarea, distribuirea și reproducerea în orice mediu sau format, atâta timp cât acordați un credit corespunzător autorilor originali și sursei, furnizați un link către licența Creative Commons și indicați dacă s-au făcut modificări. Imaginile sau alte materiale ale terților din acest articol sunt incluse în licența Creative Commons a articolului, cu excepția cazului în care se indică altfel într-o linie de credit a materialului. Dacă materialul nu este inclus în licența Creative Commons a articolului și utilizarea dorită nu este permisă de reglementările legale sau depășește utilizarea permisă, va trebui să obțineți permisiunea direct de la deținătorul drepturilor de autor. Pentru a vedea o copie a acestei licențe, vizitați http://creativecommons.org/licenses/by/4.0/ . Renunțarea la Creative Commons Public Domain Dedication ( http://creativecommons.org/publicdomain/zero/1.0/ ) se aplică datelor puse la dispoziție în acest articol, cu excepția cazului în care se specifică altfel într-o linie de credit a datelor.
Despre acest articol
Citează acest articol
Koppold-Liebscher, D., Kessler, CS, Steckhan, N. şi colab. Postul pe termen scurt însoțit de chimioterapia ca terapie de susținere în cancerul ginecologic: protocol pentru un studiu clinic controlat randomizat multicentric. Trials 21 , 854 (2020). https://doi.org/10.1186/s13063-020-04700-9