- Chris Twelves ,Michael Sabel ,Daniel Checketts ,Sharon Miller ,Bola Tayo ,Maria Jove ,Lucy Brazilia și Susan C. Scurt
- în numele grupului de studiu GWCA1208
Jurnalul Britanic al Cancerului volum 124 , pagini1379–1387 ( 2021 ) Citați acest articol
Abstract
fundal
Datele preclinice sugerează că unii canabinoizi pot exercita efecte antitumorale împotriva glioblastomului (GBM). Siguranța și eficacitatea preliminară a spray-ului de canabinoid nabiximols pentru mucoase, plus temozolomidă cu doză intensă (DIT) a fost evaluată la pacienții cu prima recurență a GBM.
Metode
Partea 1 a fost deschisă, iar partea 2 a fost randomizată, dublu-orb și controlată cu placebo. Ambele au necesitat o escaladare individuală a dozei. Pacienții au primit nabiximols (Partea 1, n = 6; Partea 2, n = 12) sau placebo (numai partea 2, n = 9); maxim 12 pulverizări/zi cu DIT până la 12 luni. Siguranța, eficacitatea și farmacocinetica (PK) temozolomidei (TMZ) au fost monitorizate.
Rezultate
Cele mai frecvente evenimente adverse apărute la tratament (TEAE; ambele părți) au fost vărsăturile, amețelile, oboseala, greața și durerile de cap. Majoritatea pacienților au prezentat TEAE de gradul 2 sau 3 (CTCAE). În partea 2, 33% dintre pacienții tratați atât cu nabiximols, cât și cu placebo au fost fără progresie la 6 luni. Supraviețuirea la 1 an a fost de 83% pentru nabiximols și 44% pentru pacienții tratați cu placebo ( p = 0,042), deși doi pacienți au murit în primele 40 de zile de la includerea în brațul placebo. Nu au existat efecte evidente ale nabiximolilor asupra TMZ PK.
Concluzii
Cu dozare personalizată, nabiximols au avut o siguranță și tolerabilitate acceptabile, fără nicio interacțiune medicament-medicament identificată. Diferențele de supraviețuire observate susțin explorarea ulterioară într-un studiu controlat randomizat cu putere adecvată.
Înregistrarea studiilor clinice
ClinicalTrials.gov: Partea 1 – NCT01812603; Partea 2 – NCT01812616.
Conținut similar fiind vizualizat de alții

Un studiu de fază II al siguranței olanzapinei pentru chimioterapia pe bază de oxaliplatină la pacienții colorectali
Articolul Acces deschis25 februarie 2021
Siguranța și tolerabilitatea asunerceptului plus radioterapie/temozolomidă standard la pacienții asiatici cu glioblastom nou diagnosticat: un studiu de fază I
Articolul Acces deschis15 decembrie 2021
Studiu de fază 1A/1B de creștere și extindere a dozei pentru a evalua siguranța, farmacocinetica, efectele alimentare și activitatea antitumorală a pamiparibului în tumorile solide avansate
Articolul Acces deschis18 noiembrie 2021
fundal
Glioblastomul (GBM) este cea mai frecventă tumoare malignă primară a creierului la adulți, cu o incidență estimată de 3,2 la 100.000 și o rată de supraviețuire la 5 ani de <6%. 1 GBM este incurabil, dar terapia optimă actuală implică o intervenție chirurgicală de debulking maximă urmată de radioterapie locală cu doze mari și chimioterapie cu temozolomidă (TMZ). 2 Cu acest tratament, supraviețuirea globală mediană (SG) este de 14,6 luni pentru pacienții suficient de bine pentru a fi supuși tratamentului. Recidiva tumorală apare la aproape toți pacienții, 3 de obicei la 6-9 luni după tratament. După recidivă, supraviețuirea mediană scade la 1,0–10,8 luni, 4 , 5 și nu există un standard actual de îngrijire pentru astfel de pacienți. 6
În ciuda eforturilor preclinice și clinice, îmbunătățirea rezultatelor pentru pacienții cu GBM s-a dovedit o provocare. Terapia suplimentară cu câmpuri de tratare a tumorii (TTF), care alternează câmpuri electrice la frecvențe și intensități specifice pentru a perturba mitoza în celulele canceroase, poate afecta OS, 7 , 8 , 9 , dar nu a devenit standard de îngrijire. În plus, s-a demonstrat că subgrupurile de pacienți GBM cu metilarea promotorului O6 – metilguanin ADN metiltransferazei (MGMT) au un prognostic mai bun și beneficiază de o terapie inițială mai agresivă cu TMZ și lomustină. 10 , 11 , 12 Ca atare, în timp ce progresele recente în patologia moleculară pot permite un tratament mai individualizat la unii pacienți, mulți pacienți cu GBM nu beneficiază, iar noi tratamente sunt necesare urgent.
Fitocanabinoizii se găsesc în mod natural în plantele de canabis și au fost utilizați medicinal de secole pentru o varietate de scopuri. 13 Δ 9 -tetrahidrocannabinol (THC) este constituentul psihoactiv major din canabis, iar canabidiolul (CBD) este constituentul major non-psihoactiv; aceștia sunt cei mai studiati canabinoizi care apar în mod natural. În studiile efectuate la animale și la oameni, THC poate exercita proprietăți analgezice, antispastice, antitremor, antiinflamatoare, stimulatoare a apetitului și antiemetice. 14 În studiile efectuate la animale și la oameni, CBD poate exercita efecte antiepileptice, neuroprotectoare, antiinflamatorii, antipsihotice, antidistonice și antiemetice. 15 , 16 , 17 , 18 , 19
Spre deosebire de THC, CBD nu are niciun efect relevant din punct de vedere fiziologic asupra receptorilor canabinoizi, CB 1 și CB 2 , dar vizează alți receptori cuplați cu proteina G, cum ar fi GPR12, GPR6, GPR3, GPR55 și 5-HT1A, precum și receptorii potențiali vaniloizi tranzitori. , TRPV1 și TRPV2. 20 , 21 , 22 , 23 , 24 , 25 THC este un agonist parţial al receptorilor CB1 şi CB2 . 26 Activarea receptorilor CB 1 și CB 2 exercită o varietate de efecte de semnalizare în aval, cu consecințe diverse asupra biologiei și funcțiilor celulare. 27
Tumorile GBM exprimă atât CB1 cât și CB2 , 28 cu tumori de grad înalt care exprimă niveluri ridicate de CB2 . Această expresie modificată a receptorilor de canabinoizi din GBM a condus la ipoteza că canabinoizii pot prezenta efecte antitumorale. Numeroase studii in vivo au descoperit că administrarea de CBD și THC a redus creșterea tumorii la modelele animale de gliom (revizuit de Rocha și colab., 2014 29 ). Se crede că aceste efecte sunt mediate de inducerea morții celulare (prin apoptoză sau autofagie citotoxică), inhibarea proliferării celulare și efecte antiangiogenice (revizuite de Dimitru și colab., 2018 30 ). Specific GBM, administrarea combinată de THC și TMZ exercită efecte antitumorale puternice în xenogrefele de gliom, efect menținut în tumorile rezistente la tratamentul cu TMZ. 31 În plus, tratamentul cu TMZ și doze submaximale de THC și CBD are o activitate antitumorală puternică atât în tumorile sensibile la TMZ, cât și în cele rezistente la TMZ. 31
Primul studiu pilot care a investigat efectele THC intracranian (100 mg mL -1 în etanol) la pacienții cu GBM recurent în 2006 a arătat o reducere a proliferării celulelor tumorale la doi din nouă pacienți. 32 Cu toate acestea, această dovadă a activității antineoplazice promițătoare a THC și CBD în GBM nu a fost încă evaluată în continuare. Sativex ® ([nabiximols oromucosal spray] GW Research Ltd [GW], Cambridge, Regatul Unit [UK]) este o formulare botanică complexă care conține THC, CBD și componente suplimentare canabinoide și non-canabinoide. Nabiximols este aprobat pentru ameliorarea simptomelor la pacienții cu spasticitate moderată până la severă din cauza sclerozei multiple care nu au răspuns adecvat la alte medicamente antispastice în >25 de țări, dar nu în Statele Unite. În acest studiu, investigăm siguranța și tolerabilitatea spray-ului buco-mucozal nabiximol în combinație cu TMZ cu doză intensă (DIT) la pacienții cu GBM recurent, așa cum se reflectă prin frecvența și severitatea evenimentelor adverse apărute la tratament (TEAE: evenimente adverse cu debut). sau agravarea după administrarea primei doze de medicament de studiu, indiferent de relația cu tratamentul). În plus, rezultatele secundare de eficacitate, în special supraviețuirea fără progresie a pacienților la 6 luni (PFS6) și OS la 1 an (adică sfârșitul planificat al tratamentului), precum și efectele nabiximolilor asupra TMZ și farmacocineticii metaboliților (PK), au fost evaluate.
Metode
Respectarea standardelor etice
Acest studiu a fost realizat în conformitate cu ghidurile de bune practici clinice ale Consiliului Internațional pentru Armonizare și principiile etice care își au originea în Declarația de la Helsinki. Protocolul a fost aprobat de Consiliul de revizuire instituțional relevant sau de Comitetul independent de etică din fiecare locație, iar toți pacienții au furnizat consimțământul informat în scris. Protocolul de studiu este înregistrat pe site-ul web ClinicalTrials.gov (Partea 1: NCT01812603; Partea 2: NCT01812616).
Reguli de oprire
Procesul ar putea fi încheiat de către sponsor, în primul rând din motive de siguranță, dar și din alte motive neprevăzute. Regulile de oprire pentru site-uri individuale și pacienți sunt descrise în Materiale suplimentare .
Pacienții
Pacienții eligibili au fost ≥18 ani cu un diagnostic confirmat histopatologic de GBM (clasificarea Organizației Mondiale a Sănătății [versiunea 2007 33 ]) și dovezi de progresie a primei boli, după radioterapie și chimioterapie de primă linie cu TMZ. Pacienții aveau o stare de ≥60% Karnofsky Performance Scale (KPS) și, dacă luau steroizi, aveau o doză stabilă sau reducătoare. Toți pacienții au primit îngrijiri standard (adică 6 săptămâni radioterapie cu TMZ concomitent apoi TMZ adjuvant).
Design de probă
Acesta a fost un studiu de fază 1b în mai multe locuri, secvenţial, în două părţi. Pacienții au fost înrolați în Partea 1 (deschis) sau Partea 2 (randomizat, dublu-orb, controlat cu placebo; alocare 1:1), ambele au urmat același program de vizite și proceduri (vezi Fig. 1 suplimentară ). Pacienților înscriși în partea 1 nu li sa permis intrarea în partea 2. Studiul a fost efectuat în 10 locații (7 din Marea Britanie; 3 din Germania) între ianuarie 2014 și august 2016.
Nabiximols și dozare placebo
Datorită gradului ridicat de variabilitate interpacient a PK-urilor și a farmacodinamicii nabiximolilor 34 , 35 , regimul de dozare a fost o doză individualizată de 3-12 pulverizări/zi, bazată pe un studiu de dozare care a arătat un profil favorabil risc/beneficiu în pacientii cu dureri cronice. 36 În ambele părți ale studiului, tratamentul a început cu o singură pulverizare în seara zilei 1, cu titrare individualizată graduală a nabiximolilor sau placebo (numai în partea 2) cu 1 pulverizare suplimentară/zi, până la o doză maximă bazată pe tolerabilitatea de până la 12 spray-uri/zi (30 mg CBD și 32,4 mg THC). Dacă un pacient a prezentat reacții adverse inacceptabile în timpul titrarii, doza a fost redusă până când efectele secundare s-au rezolvat. Pacienții au acceptat o doză maximă tolerată personalizată (MTD) în decurs de 14 zile de la prima doză de nabiximols sau placebo și au continuat cu acea doză pentru restul studiului. Dacă pacienții au prezentat reacții adverse inacceptabile în perioada următoare titrarii, li s-a sfătuit să-și reducă ușor doza până când acestea s-au rezolvat.
Partea 1
Șase pacienți au participat la partea 1 (deschis) în două cohorte de trei pacienți fiecare. Toți au primit nabiximols și DIT cu TEAE înregistrate conform criteriilor terminologice comune pentru evenimente adverse (CTCAE versiunea 4.03).
O echipă de evaluare a siguranței (SRT) a evaluat progresul părții 1 (deschis) a studiului pentru a determina dacă a doua cohortă din partea 1 și, ulterior, partea 2 ar putea începe, așa cum este descris în materiale suplimentare .
Partea 2
După aprobarea de la SRT, 21 de pacienți au fost randomizați pentru a primi DIT plus nabiximols sau placebo folosind un raport de alocare de 1:1.
Proceduri de încercare
Pacienții au început DIT în Ziua 7 (85,0 mg/m2 pe zi) și s-au întors la locurile de studiu în Ziua 1 când au fost eliberați nabiximols (părțile 1 și 2) sau placebo (numai partea 2). Pacienții au dotat nabiximols/placebo așa cum este descris mai sus. Pacienții au fost instruiți să ia nabiximols sau placebo la MTD personalizat timp de 1 an sau până la retragerea studiului; regulile individuale de oprire sunt date în Materiale suplimentare . DIT a fost administrat pe cale orală timp de 13 cicluri fiecare a câte 28 de zile, adică până la 1 an cu dozare în Zilele 1-21 ale fiecărui ciclu urmată de 7 zile de pauză; doza zilnică ar putea fi redusă la 70% și, ulterior, la 50% dacă pacienții au prezentat AET hematologice legate de DIT.
Farmacocinetica
Au fost investigate efectele adăugării nabiximolilor la TMZ asupra PK a TMZ și a metabolitului său, 4-amino-5-imidazol-carboxamidă (AICA). Metodele de colectare, procesare și bioanaliza a probelor de sânge sunt descrise în Materiale suplimentare .
Parametrii PK au fost obținuți prin analiză necompartimentală utilizând WinNonlin ® versiunea 6.3 și au inclus zona de sub curba concentrației plasmatice-timp până la 6 ore (ASC 0-6h ) și până la ultimul punct temporal (ASC 0-t ), concentrația plasmatică maximă (Cmax). max ), timpul de înjumătățire terminal (eliminare) (t ½ ), timpul până la concentrația plasmatică maximă (t max ), clearance-ul oral aparent după administrare orală (CL/F) și volumul aparent de distribuție după administrare non-intravenoasă (V z / F).
Randomizare și orbire
Doar pentru partea 2 (randomizat), un program de alocare a tratamentului 1:1 cu blocuri echilibrate permutate aleatoriu folosind un algoritm bazat pe computer a fost produs independent; Consultați Materiale suplimentare pentru informații suplimentare. Pacienții, anchetatorii și sponsorul au fost orbiți față de alocare și au rămas așa până la închiderea studiului.
Măsuri finale
Obiectivul principal al acestui studiu a fost de a investiga tolerabilitatea și siguranța spray-ului nabiximols la pacienții cu GBM recurent, așa cum este indicat de frecvența și severitatea TEAE. Obiectivele secundare au inclus investigarea eficacității preliminare a nabiximolilor în comparație cu placebo, determinată de PFS6 (s-au efectuat scanări prin rezonanță magnetică [RMN] pentru evaluarea tumorii conform consensului internațional atât pentru practică, cât și pentru studii, prin evaluarea revizuită în criteriile de neuro-oncologie [RANO] [informații suplimentare RMN pot fi găsite în Materiale suplimentare ]) 3 , 37 și supraviețuirea la 1 an. Alte obiective secundare au fost determinarea oricăror efecte ale nabiximolilor asupra TMZ PK.
Analize neplanificate (post-hoc).
Deoarece studiul nu a fost conceput pentru a investiga diferențele de supraviețuire, a fost întreprinsă o analiză post-hoc de supraviețuire pe 2 ani pentru a investiga în continuare efectul tratamentului la pacienții individuali, folosind calculatorul de prognostic al Organizației Europene pentru Cercetare și Tratamentul Cancerului (EORTC) al supraviețuirii în pacienţii cu GBM recurent. 38 Aceasta a calculat o valoare mediană (și interval) estimată de OS pentru fiecare pacient din studiu, care a fost comparată cu rezultatele reale. Pacienții au fost urmăriți până la 27,5 luni.
analize statistice
Marime de mostra
Acesta a fost un studiu exploratoriu de fază 1b fără un calcul formal al mărimii eșantionului. Partea 1 (deschisă) a planificat să înscrie șase pacienți, iar Partea 2 (randomizată) a planificat să înscrie 20 de pacienți.
metode statistice
Toate ipotezele au fost testate la un nivel de 5% de semnificație statistică nominală folosind un test cu două fețe. Datorită naturii exploratorii a acestui studiu, nu s-au făcut ajustări pentru teste multiple; Partea 2 a fost randomizată pentru a asigura echilibrul și limitarea părtinirii în comparațiile de siguranță. Setul de analiză de siguranță a fost utilizat pentru analiza tuturor parametrilor de rezultat. Informații suplimentare pot fi găsite în Materiale suplimentare .
Rezultate
Dispunerea pacienților
Partea 1
Șase pacienți înscriși în partea 1 (deschis), au primit nabiximols spray așa cum era planificat și au fost incluși în analiza de siguranță.
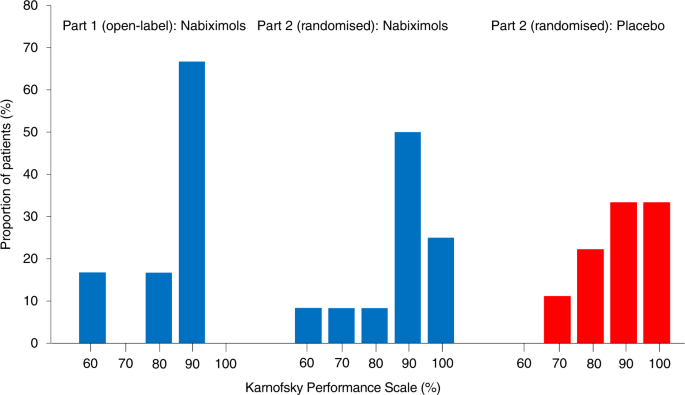
Vârsta medie a pacienților a fost de 50,2 ani (mediana 57, interval: 28-67 ani), iar timpul mediu până la diagnosticarea GBM recurentă de la diagnosticul inițial a fost de 18,9 luni (mediana 20,2 luni, interval: 8,6-25,7 luni). Timpul mediu până la pacienții care au intrat în studiu după diagnosticul de recurență a fost de 1 lună (mediană 1,1 luni, interval: 0,5-2,2 luni). Mediana KPS la momentul inițial a fost de 90% (Tabelul suplimentar 1 ); proporţia pacienţilor din fiecare categorie KPS este prezentată în Fig. 1 .
Trei pacienți (50,0%) au ieșit din studiu din cauza TEAE de gradul 1 și 2 (unul din cauza letargiei, amețelii și oboselii, unul din cauza greaței, diareei și vărsăturilor și unul din cauza stării de spirit depresive) și trei (50,0%) din cauza progresia bolii după o medie generală de 4,13 luni pentru cei șase pacienți care au ieșit din studiu (Fig. 2a ). Nu au existat decese în timpul tratamentului cu nabiximols; Cu toate acestea, trei pacienți au murit ulterior după ce au ieșit din studiu.
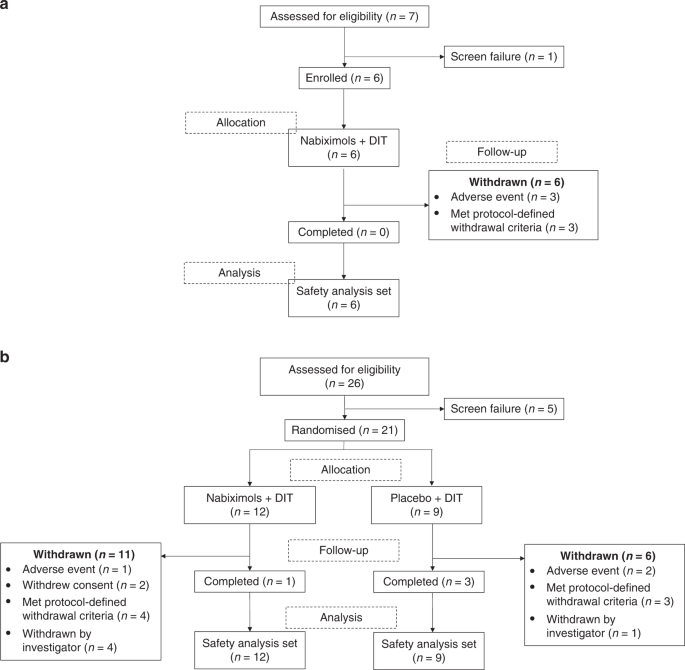
Partea 2
Douăzeci și unu de pacienți au fost randomizați în partea 2 a studiului; 12 au primit nabiximols și nouă au primit placebo și toate au fost incluse în analiza de siguranță.
Vârsta medie a fost de 57,8 ani în ambele grupuri de tratament (mediana nabiximols 59, interval: 39-72 ani; mediana placebo 57, interval: 43-71 ani). În brațele de tratament cu nabiximols și placebo, 41,7% și, respectiv, 88,9% dintre pacienți au fost bărbați. Timpul mediu până la diagnosticarea GBM recurentă de la diagnosticul inițial a fost de 23,7 luni (mediană 22,9 luni, interval: 3,1-43,4 luni; grupul cu nabiximols) și 21,7 luni (mediană 19,6 luni, interval: 6,2-55,7 luni; grupul placebo). Timpul mediu până la pacienții care au intrat în studiu după diagnosticul de recidivă a fost de 1,6 luni (mediană 0,8 luni, interval: 0,4-6,8 luni; grupul cu nabiximols) și 0,8 luni (mediana 0,8 luni, interval: 0,1-2,0 luni; grupul placebo). Mediana KPS la momentul inițial a fost de 90% pentru ambele grupuri de pacienți (Tabelul suplimentar 1 ); proporţia pacienţilor din fiecare categorie KPS este prezentată în Fig. 1 .
În partea 2, 17 pacienți au ieșit din studiu (11 nabiximols și 6 placebo) și 4 pacienți (1 nabiximols și 3 placebo) au finalizat studiul (~ 1 an de tratament) (Fig. 2b ). Șapte (41,2%) pacienți au ieșit din studiu din cauza progresiei bolii (3 au primit placebo; 4 au luat nabiximols, dintre care 1 a enumerat, de asemenea, intoleranța la TMZ ca motiv de retragere), 5 (29,4%) ca urmare a unei decizii a investigatorului (1). considerat prea bolnav pentru a continua medicația sau chimioterapia studiului [pacientul a fost internat din cauza unei infecții urinare recurente care a durat 3 luni] și 4 din cauza progresiei bolii), 3 (17,6%) din cauza TEAE (1 din cauza tulburării de concentrare și urinare). incontinență și 2 din cauza progresiei bolii) și 2 (11,8%) din cauza retragerii consimțământului (1 din cauza pacientului care se simte prea rău pentru a continua și 1 din cauza pacientului care se simte ca și cum ar fi experimentat toxicitate pentru medicația de studiu și concomitent cu acestea). medicamente [deși nu au fost raportate TEAE asociate], necesitând retragerea conform protocolului).
Șapte (33,3%) pacienți au murit în timpul părții 2, 5 (55,6%) care au primit placebo și 2 (16,7%) au luat nabiximols. Înainte de moarte, toți pacienții au ieșit din studiu din cauza progresiei bolii, cu excepția unui pacient care ia nabiximols care a ieșit din studiu din cauza TEAE.
Expunerea la medicamente
Partea 1
În partea 1, odată ce titrarea a fost finalizată și s-a stabilit o doză personalizată stabilă de nabiximols, pacienții au luat o medie de 6 pulverizări/zi (interval: 3,3-12 pulverizări/zi). Durata medie de expunere a fost de 16 săptămâni (mediană 15,1 săptămâni, interval: 3,9-31 săptămâni). Doza medie de DIT a fost de 146,6 mg (mediană 145,0 mg, interval: 93,8–195,0 mg) sau 77,8 mg/m2 ( mediană 82,9 mg/m2 , interval: 49,2–85,4 mg/m2 ) în raport cu suprafața corpului.
Partea 2
Pacienții care au luat nabiximols au administrat în medie 7,5 pulverizări/zi după perioada de titrare (interval: 2,0–12 pulverizări/zi); doar un pacient a luat mai puțin decât doza zilnică minimă recomandată. Durata medie de expunere la nabiximols a fost de 24,9 săptămâni (mediană 22,1 săptămâni, interval: 7,1-50,9 săptămâni). Doza medie de DIT a fost de 154,7 mg (mediană 153,9 mg, interval: 117,5–185,0 mg) sau 81,2 mg/m2 ( mediană 83,3 mg/m2 , interval: 56,2–87,3 mg/m2 ) în raport cu suprafața corpului.
Pacienții cărora li s-a administrat placebo au administrat o medie de 10 pulverizări/zi după perioada de titrare (interval: 7,0–12 pulverizări/zi), iar durata medie de expunere a fost de 23,6 săptămâni (mediană 19,1 săptămâni, interval: 1,9–51,3 săptămâni). Doza medie de DIT a fost de 165,6 mg (mediană 170,0 mg, interval: 125,0–195,0 mg), cu o doză medie raportată la suprafața corporală de 81,1 mg/m2 ( mediană 83,6 mg/m2 , interval: 63,3–86,5 mg). /m2 ) .
Siguranță și tolerabilitate
În ambele părți ale studiului, cele mai frecvente rezultate de laborator potențial semnificative din punct de vedere clinic au fost fie un număr scăzut de celule albe din sânge, fie un nivel crescut al enzimelor hepatice. Rezultatele anormale de laborator, raportate ca TEAE, au fost în concordanță cu boala de bază a pacienților și cu tratamentul cu TMZ. Nu au existat constatări neașteptate la examenul fizic, electrocardiogramă sau semnele vitale. În comparație cu experiența anterioară în studiile cu nabiximols, nu au fost identificate noi probleme legate de siguranță.
Partea 1
Nu au existat decese în timpul Părții 1. Trei (50,0%) pacienți au prezentat TEAE, care au condus la întreruperea tratamentului și trei (50,0%) au întrerupt tratamentul din cauza progresiei bolii. TEAE-urile care au condus la întreruperea tratamentului au fost diferite între pacienți, iar severitatea maximă a fost CTCAE de gradul 2.
Tabelul 1 raportează TEAE experimentate la ≥2 pacienți și severitatea maximă a acestora. Oboseala, amețelile, durerile de cap, vărsăturile și greața au fost cele mai frecvent observate TEAE. Oboseala, amețelile și durerile de cap sunt asociate în mod obișnuit cu GBM (oboseala și amețelile sunt, de asemenea, efecte secundare frecvente ale nabiximols), iar incidența greață și vărsături este de așteptat cu chimioterapie și un efect secundar recunoscut al nabiximols. EA grave observate au fost progresia neoplasmului pentru un pacient și hemoragia intracraniană (gradul 1) și crizele focale (gradul 1) pentru altul; pacientul care a prezentat hemoragie intracraniană nu a avut modificări la medicația de studiu la momentul evenimentului.Tabelul 1 Evenimente adverse apărute în urma tratamentului cu toate cauzele raportate la ≥2 pacienți (set de analiză de siguranță).
Partea 2
Doi pacienți (22,2%) din grupul placebo și niciunul din grupul cu nabiximols au murit din cauza progresiei bolii până la momentul ultimei urmăriri planificate.
Ratele TEAE care au condus la întreruperea tratamentului au fost similare în ambele grupuri de tratament (doi pacienți în fiecare grup [16,7% nabiximols vs. 22,2% placebo]). Un pacient din fiecare grup a întrerupt tratamentul din cauza progresiei bolii. TEAE-urile care au condus la sevraj la ceilalți doi pacienți au fost tulburări de atenție, vărsături, ataxie și incontinență urinară pentru pacientul placebo și infecția tractului urinar pentru pacientul cu nabiximols.
Tabelul 1 raportează TEAE experimentate la ≥2 pacienți și severitatea maximă a acestora. Incidența TEAE a fost similară în ambele brațe de tratament. Vărsăturile, amețelile, greața și oboseala au fost cele mai frecvent observate TEAE. Pacienții care au luat nabiximols au raportat TEAE mai severe și au avut o incidență mai mare a TEAE grave. Patru pacienți care au luat nabiximols au prezentat TEAE grave, după cum urmează: infecție a tractului urinar pentru un pacient, infecție a tractului respirator inferior și anemie pentru altul, gastroenterită campylobacter și astenie pentru al treilea și fecalom pentru al patrulea pacient. Doi pacienți din grupul placebo au prezentat TEAE grave, după cum urmează: progresia neoplasmului și embolia pulmonară pentru primul pacient și progresia neoplasmului pentru al doilea pacient.
Tabelul suplimentar 2 prezintă toxicitățile maxime ale TEAE experimentate de fiecare pacient și orice acțiune întreprinsă ca urmare.
Eficacitate exploratorie
Supraviețuire fără progresie la 6 luni
În partea 1, un pacient (16,7%) a fost clasificat ca fără progresie la șase luni, patru (66,7%) pacienți au progresat și starea răspunsului a fost necunoscută pentru unul (16,7%) pacient.
În partea 2, în grupul tratat cu nabiximols, patru (33,3%) pacienți au fost clasificați ca fără progresie la șase luni, șapte (58,3%) pacienți au progresat și starea răspunsului a fost necunoscută pentru unul (8,3%) pacient. În grupul placebo, trei (33,3%) pacienți au fost clasificați ca fără progresie la șase luni, cinci (55,6%) pacienți au progresat și starea de răspuns a fost necunoscută pentru unul (11,1%) pacient.
Analiza supraviețuirii la 1 an
În partea 1, la 1 an, trei din șase (50,0%) pacienți care luau nabiximols erau în viață.
În Partea 2, la 1 an, 10 din 12 (83,3%) pacienți care au luat nabiximols erau în viață față de patru din nouă (44,4%) pacienți care au primit placebo; deși studiul nu a avut putere statistică pentru a compara OS, această diferență în rata de supraviețuire la un an care favorizează nabiximols a atins o semnificație statistică nominală ( p = 0,042, testul log-rank; Fig. 3 ).
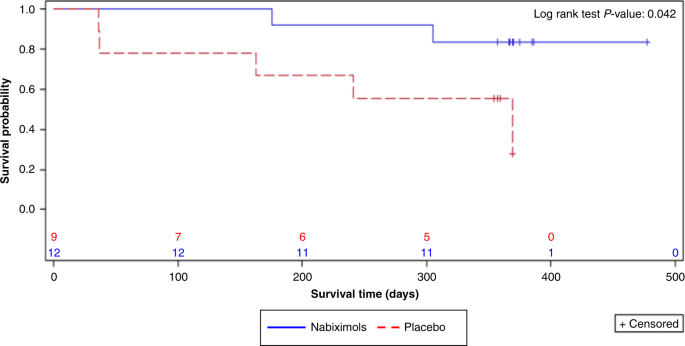
Analize post-hoc de supraviețuire la 2 ani
Au fost, de asemenea, disponibile date de supraviețuire la doi ani din urmărirea electivă a tuturor pacienților (părțile 1 și 2) pentru un maxim de 27,5 luni în afara protocolului, cu OS la 2 ani de 50% pentru pacienții tratați cu nabiximols și 22% pentru cei tratați. tratat cu placebo ( p nominal = 0,134, testul log-rank). Mediana OS a fost estimată la 21,8 luni (interval de încredere 95% [IC]: 10,0, nu se poate calcula [NC] ca evenimente insuficiente) pentru grupul cu nabiximols și 12,1 luni (IC 95%: 1,18, NC) pentru grupul placebo.
Analiza post-hoc folosind calculatorul de prognostic EORTC al supraviețuirii pentru pacienții cu GBM recurent a fost utilizată pentru a calcula o valoare mediană (interval) estimată a OS pentru fiecare pacient din studiu la înscriere, care a fost apoi comparată cu rezultatul real pentru toți pacienții pe baza duratei de 1 an. supraviețuire (Tabelul suplimentar 3 [Partea 2]; Tabelul suplimentar 4 [Partea 1]).
În partea 2 a studiului, 10 (83,3%) pacienți care au luat nabiximols au avut OS care a depășit timpul mediu de supraviețuire estimat de EORTC; șapte (58,3%) au depășit intervalul superior al timpului mediu de supraviețuire estimat de EORTC (Tabelul suplimentar 3 ). Doar un pacient (8,3%) care a luat nabiximols a supraviețuit mai puțin decât timpul de supraviețuire estimat în intervalul cel mai scăzut.
În schimb, doar trei (33,3%) pacienți din grupul placebo au avut OS care a depășit supraviețuirea mediană estimată de EORTC, un pacient (11,1%) a avut OS conform supraviețuirii mediane estimate de EORTC și doar un pacient (11,1%). au depășit intervalul superior al timpului mediu de supraviețuire estimat de EORTC. Un pacient (11,1%) era încă în viață după 25,5 luni, așa că nu se știa dacă ar depăși intervalul superior prezis (38,9 luni) în timpul urmăririi prelungite. Doi (22,2%) pacienți cărora li s-a administrat placebo și care au decedat în timpul studiului au avut OS care s-au încadrat în intervalele lor prezise, iar doi (22,2%) pacienți au avut un timp de OS care a fost sub cel mai mic timp prezis. Un pacient (11,1%), care a întrerupt studiul din cauza progresiei rapide și mai târziu a murit, nu a putut avea un timp de supraviețuire prezis definit de instrumentul EORTC (Tabelul suplimentar 3 ).
Farmacocinetica
Pacienții excluși din analiza PK sunt descriși în Materiale suplimentare . În părțile 1 și 2, nu a existat niciun efect asupra expunerii la TMZ sau AICA (C max și ASC 0-t ) sau t max atunci când pacienții au luat DIT singur (Ziua 1) în comparație cu administrarea concomitentă cu nabiximols (Ziua 36) (Supliment Tabelul 5 și, respectiv, Tabelul suplimentar 6 ).
Analiza statistică a fost efectuată numai pentru partea 2. Pentru TMZ, raportul dintre mediile geometrice ale celor mai mici pătrate (LS) (IC 95%) dintre grupurile nabiximols și placebo pentru modificarea TMZ s-a apropiat de 1 pentru toți parametrii de expunere și a fost de 1,02 (0,78, 1,33) pentru C max , 0,95 (0,82). , 1,11) pentru AUC0-6h şi 0,91 (0,78, 1,05) AUC0 -t .
Pentru AICA, raportul dintre mediile geometrice LS (95% CI) dintre grupurile nabiximols și placebo pentru modificarea TMZ a fost ușor mai mare decât 1 pentru toate, cu excepția AUC 0-t și a fost 1,66 (0,70, 3,89) pentru C max , 1,21 (0,75, 1,95) pentru AUC0-6h şi 1,00 (0,64, 1,57) pentru AUC0 -t .
Discuţie
Acest studiu de fază 1b și-a propus să evalueze în primul rând siguranța și tolerabilitatea și, în al doilea rând, eficacitatea nabiximolilor la pacienții cu GBM recurent. În absența unui standard acceptat de îngrijire pentru această populație și a niciunui regim de dozare convențional cunoscut pentru DIT, a fost ales un regim DIT de 85 mg/m2 / zi ca chimioterapie principală, deoarece rezistența la temozolomidă este mediată parțial de MGMT și MGMT. poate fi epuizată prin administrarea prelungită de temozolomidă. Prin urmare, un regim DIT poate depăși rezistența 39 și a fost considerat un comparator optim. Rezultatele au arătat fezabilitatea unui regim de dozare personalizat de nabiximols în combinație cu DIT la pacienții cu GBM recurent, conform măsurilor de rezultat primar care informează siguranța și tolerabilitatea. În plus, au fost evaluate rezultatele secundare ale eficacității și efectul nabiximolilor asupra TMZ PK. Deși ambele părți 1 și 2 ale studiului au sugerat o eficacitate crescută, așa cum este definită de timpul de supraviețuire, la pacienții tratați cu nabiximols adjuvant, orice concluzie privind eficacitatea este limitată de dimensiunea mică a eșantionului și de factorii potențial de confuzie care pot diferi între cohorte. Rezultatele PK au sugerat că nu a existat un efect semnificativ al nabiximolilor asupra expunerii sistemice la TMZ atunci când a fost administrat ca parte a DIT.
Există un număr tot mai mare de cercetări preclinice care susțin activitatea antitumorală a canabinoizilor, inclusiv THC și CBD. 29 , 30 Tratamentul cu TMZ și doze submaximale de THC și CBD a produs o acțiune antitumorală puternică atât în xenogrefele GBM sensibile la TMZ, cât și în cele rezistente la TMZ. 31 Primul studiu pilot care a evaluat siguranța și eficacitatea THC administrat intratumoral la nouă pacienți cu GBM recurent a arătat un profil bun de siguranță și posibile efecte antiproliferative ale THC la doi pacienți; cu toate acestea, efectele asupra supraviețuirii au fost neclare. 32 Edemul cerebral a fost experimentat de toți pacienții din acel studiu în perioada postoperatorie timpurie după craniotomie. În plus, au existat episoade ușoare, tranzitorii de bulimie, hipotermie și euforie la un singur pacient. 32
Scopul principal al prezentului studiu a fost de a analiza siguranța și tolerabilitatea dozării personalizate a spray-ului nabiximol pentru mucoase, atunci când este administrat concomitent cu DIT. Trebuie remarcat faptul că concluziile privind siguranța din acest studiu s-ar putea să nu se traducă într-o populație de pacienți mai puțin aptă. Incidența TEAE în acest studiu a fost mare atât la pacienții tratați cu nabiximols, cât și la pacienții tratați cu placebo, din motivele discutate mai sus. În partea 1 (deschis), majoritatea TEAE au fost ușoare (CTCAE grad 1) sau moderate (grad 2), cele mai frecvent raportate fiind oboseala, amețelile, durerile de cap și vărsăturile. Nu au existat TEAE de gradul 4.
În partea 2 (randomizat), incidența TEAE a fost mai mare în grupul cu nabiximols decât grupul placebo, iar cei care au luat nabiximols au raportat TEAE mai severe și au avut o incidență mai mare a TEAE grave. Cele două decese în timpul studiului au avut loc în grupul placebo și s-au datorat progresiei bolii. Acest lucru ar trebui luat în considerare în contextul mărimii eșantionului general ( n = 21) din partea 2 a studiului, cu 12 pacienți care au primit nabiximols și 9 placebo.
Incidența TEAE în acest studiu a fost mai mare decât în studiile clinice randomizate de fază 3 anterioare cu nabiximols ca analgezic adjuvant la pacienții cu cancer avansat (68-72% la pacienții tratați cu nabiximols și 64-66% la pacienții tratați cu placebo 34 , 35 ). Având în vedere natura indicației prezente, multe TEAE neurologice și de altă natură au fost considerate legate de GBM subiacent al pacientului. În plus, durata tratamentului în studiul actual a fost de 1 an, comparativ cu 5-7 săptămâni în studiile anterioare de fază 3. 34 , 35 În cele din urmă, pacienții din studiul actual au primit chimioterapie concomitentă, care a fost exclusă în studiile anterioare de fază 3. Prin urmare, populația de pacienți și regimul de tratament au fost diferite de alte studii de fază 3 și ar putea explica, parțial, de ce au existat mai multe TEAE în studiul actual de fază 1b.
Atribuirea specifică a TEAE este complicată de prezentarea clinică a GBM, istoricul natural al bolii și administrarea concomitentă de chimioterapie citotoxică. Datorită naturii paliative a tratamentelor GBM și lipsei agenților terapeutici care sunt eficienți cu o frecvență și un profil de severitate TEAE potențial acceptabil, rezultatele acestui studiu ar putea sprijini studiile clinice suplimentare care evaluează eficacitatea nabiximolilor adjuvanti în GBM recurent.
Evaluarea exploratorie a eficacității sa bazat pe PFS6 și OS ale pacienților la 1 an (adică sfârșitul planificat al tratamentului). Evaluările RANO ale imaginilor RMN nu au arătat niciun efect aparent al nabiximolilor asupra PFS6, cu aceeași proporție de pacienți (33%) din grupurile cu nabiximols și placebo fără progresie la șase luni. În partea 1 (tratament cu nabiximols deschis), PFS6 a fost de 16,7%. În ambele părți ale studiului, PFS6 a fost mai mare decât cea raportată anterior, în timp ce datele reunite din 16 studii de fază 2 la 345 de pacienți cu GBM recurent care au primit radioterapie și diferite terapii farmaceutice au arătat un PFS6 de numai 9%. 36 În partea 1 a studiului, OS la 1 an s-a dovedit a fi îmbunătățit în comparație cu datele publicate anterior, care au pus rata mortalității la ~80%. 36 În partea 2 a studiului, o îmbunătățire semnificativă a OS a fost observată la 1 an la pacienții care au luat nabiximols față de placebo (83% față de 44%; testul log-rank, p nominal = 0,042). Este de remarcat faptul că ratele OS la 1 an în ambele grupuri de tratament au fost mai mari decât datele reunite din mai multe studii publicate cu alți agenți, unde OS la 1 an la 345 de pacienți cu GBM recurent a fost de doar 14%. 36 Sistemul de operare ridicat din studiul nostru trebuie luat în considerare cu atenție, deoarece poate fi explicat în parte prin dimensiunea mică a eșantionului.
Pe baza datelor din urmărirea electivă extinsă (până la maximum 27,5 luni) la un număr mic de pacienți înscriși inițial în Partea 2 ( n = 21), SG median a fost estimat a fi mai lung în grupul tratat cu nabiximols la 21,8 luni. (IC 95%: 10,0, NC) vs. 12,1 luni (IC 95%: 1,18, NC) pentru placebo. Această durată estimată a OS este mai mare decât cea raportată anterior atât la pacienții nou diagnosticați cu GBM, cât și la cei cu GBM recurent. 8 , 40 Un studiu recent de fază 3 care a analizat impactul TTF-urilor la 695 de pacienți nou diagnosticați cu GBM a urmărit pacienții pentru o perioadă mediană de 40 de luni (466 au primit TTF plus TMZ; 229 au primit TMZ singur) și a raportat SG median de 20,9 luni în TTF-uri plus grupul TMZ și 16,0 luni în grupul TMZ singur. 40 Un studiu de fază 3 care a analizat impactul TTF-urilor la 237 de pacienți cu GBM recurent a urmărit pacienții pentru o perioadă mediană de 39 de luni (120 au primit numai TTF; 117 au primit numai chimioterapie) și a raportat SG median de 6,6 luni în grupul TTF singur față de 6,0. luni în grupul numai cu chimioterapie. 8 Recunoaștem că aceste date provin de la populații mai mari și mai eterogene decât populația studiată în studiul de față. Nu am colectat informații despre tratament după întreruperea medicamentului de studiu ca parte a acestui studiu, așa că nu putem discuta impactul potențial al tratamentelor post-test asupra OS. Cu toate acestea, nu există intervenții cunoscute care să îmbunătățească semnificativ supraviețuirea după întreruperea tratamentului de linia a doua la acest grup de pacienți. Mai mult, așa cum s-a discutat mai sus, acest studiu de fază 1b a avut o dimensiune mică a eșantionului și un posibil dezechilibru în factorii de confuzie între grupurile de tratament ar fi putut afecta interpretarea datelor OS. De asemenea, de interes în studiul actual a fost tendința ca pacienții tratați cu nabiximols de a avea un OS care depășește adesea intervalul superior al supraviețuirii estimate de EORTC (58% pacienți tratați cu nabiximols față de 11% pacienți placebo [Partea 2]). Deși acest model nu a fost dezvoltat în mod specific pe baza datelor de la pacienții care au primit DIT, nu există niciun motiv a priori să se creadă că acest lucru invalidează modelul de predicție a supraviețuirii la pacienții tratați cu DIT.
De notat, doi pacienți din grupul placebo au murit în decurs de 40 de zile de la începerea tratamentului în partea 2 a studiului. Nu poate fi exclus ca cei doi pacienți în cauză să fi fost predispuși la moarte prematură, de exemplu, în virtutea biologiei lor tumorale, inclusiv a statutului de MGMT nemetilat. Lipsa clasificării detaliate a tumorii și a documentării terapiei anterioare este o limitare notabilă a acestui studiu și este recunoscută necesitatea unei caracterizări complete în studiile viitoare, inclusiv a stării de metilare a MGMT. Deși nu se așteaptă rezultate diferite între bărbați și femei, trebuie remarcat dezechilibrul considerabil dintre bărbați și femei în acest studiu.
Un obiectiv final al acestui studiu a fost de a evalua efectul nabiximolilor asupra PK a TMZ și AICA, pentru a investiga o interacțiune medicament-medicament. Nu au existat efecte relevante ale nabiximolilor asupra parametrilor de expunere la TMZ sau AICA (C max și ASC 0-t ), sugerând că nu există un impact important din punct de vedere clinic al nabiximolilor asupra PK a TMZ. Impactul TMZ asupra PK al THC, CBD sau metaboliților acestora nu a fost evaluat în acest studiu.
Puncte forte și limitări ale încercării
Punctele forte ale studiului au fost titrarea individualizată și dozarea personalizată a nabiximolilor și natura randomizată, controlată cu placebo a Părții 2. Fără randomizare și control placebo, interpretarea OS la pacienții tratați cu nabiximols ar fi fost confundată.
Limitarea majoră este că numărul de pacienți înrolați în partea 2 a studiului a fost mic și, cu 21 de pacienți înrolați în nouă locații pentru partea 2, a existat o potențială eterogenitate a practicii și părtinire în selecția pacienților între site-uri. În plus, 12 pacienți au fost repartizați la nabiximols și nouă la placebo în timpul părții 2; acest dezechilibru s-a datorat stratificării randomizării în funcție de locație. Prin urmare, deși studiul a fost randomizat, este posibil să existe un anumit dezechilibru între pacienții din brațele nabiximols și placebo, ceea ce ar putea explica decesul a doi pacienți alocați la placebo în decurs de 40 de zile de la înscriere. De asemenea, nu a existat un calcul de putere prespecificat pentru a determina numărul minim de pacienți necesar pentru o putere statistică adecvată pentru obiectivele de eficacitate. În plus, studiul a folosit un regim de dozare DIT neconvențional. În cele din urmă, instrumentul EORTC pentru a contextualiza datele OS pentru pacienții individuali a fost implementat după inițierea studiului. Prin urmare, aceste date trebuie interpretate cu prudență.
Concluzie
Sprayul cu Nabiximols a părut tolerabil, iar dozarea personalizată a fost fezabilă la această populație de pacienți GBM. Nu au fost identificate noi probleme legate de siguranță și nu au existat dovezi care să sugereze un efect al nabiximolilor asupra PK a TMZ. Diferențele de supraviețuire observate trebuie interpretate cu prudență și justifică explorarea ulterioară într-un studiu controlat randomizat cu putere adecvată.
Referințe
- Ostrom, QT, Gittleman, H., Xu, J., Kromer, C., Wolinsky, Y., Kruchko, C. și colab. Raport statistic CBTRUS: tumori cerebrale primare și alte tumori ale sistemului nervos central diagnosticate în Statele Unite în 2009-2013. Neuro Oncol. 18 (Suppl 5), v1–v75 (2016).Articol Google Academic
- Stupp, R., Mason, WP, van den Bent, MJ, Weller, M., Fisher, B., Taphoorn, MJ și colab. Radioterapia plus temozolomidă concomitentă și adjuvantă pentru glioblastom. N. Engl. J. Med. 352 , 987–996 (2005).Articol CAS Google Academic
- Seystahl, K., Wick, W. & Weller, M. Opțiuni terapeutice în glioblastomul recurent – o actualizare. Crit. Rev. Oncol. Hematol. 99 , 389–408 (2016).Articol Google Academic
- Carson, KA, Grossman, SA, Fisher, JD & Shaw, EG Factorii de prognostic pentru supraviețuirea la pacienții adulți cu gliom recurent s-au înrolat pe noi abordări ale terapiei tumorilor cerebrale „NABTT” ale consorțiului SNC de faza I și II din studiile clinice. J. Clin. Oncol. 25 , 2601–2606 (2007).Articol Google Academic
- Park, JK, Hodges, T., Arko, L., Shen, M., Dello Iacono, D., McNabb, A. et al. Scala pentru a prezice supraviețuirea după intervenția chirurgicală pentru glioblastom multiform recurent. J. Clin. Oncol. 28 , 3838–3843 (2010).Articol Google Academic
- Weller, M., van den Bent, M., Hopkins, K., Tonn, JC, Stupp, R., Falini, A. şi colab. Ghidul EANO pentru diagnosticul și tratamentul glioamelor și glioblastomului anaplazic. Lancet Oncol. 15 , e395–e403 (2014).Articol Google Academic
- Mun, EJ, Babiker, HM, Weinberg, U., Kirson, ED și Von Hoff, DD Câmpuri de tratare a tumorilor: o a patra modalitate de tratament al cancerului. Clin. Cancer Res . 24 , 266–275 (2018).
- Stupp, R., Wong, ET, Kanner, AA, Steinberg, D., Engelhard, H., Heidecke, V. şi colab. NovoTTF-100A versus chimioterapia la alegerea medicului în glioblastomul recurent: un studiu randomizat de fază III al unei modalități noi de tratament. EURO. J. Cancer 48 , 2192–2202 (2012).Articol Google Academic
- Stupp, R., Taillibert, S., Kanner, AA, Kesari, S., Steinberg, DM, Toms, SA și colab. Terapia de întreținere cu câmpuri de tratare a tumorii plus temozolomidă vs temozolomidă în monoterapie pentru glioblastom: un studiu clinic randomizat. JAMA 314 , 2535–2543 (2015).Articol CAS Google Academic
- Tanaka, S., Akimoto, J., Narita, Y., Oka, H. & Tashiro, T. Este valoarea absolută a ARN-ului mesager al genei O(6)-metilguanin-ADN-metiltransferazei un factor de prognostic și prezice aceasta rezultatele tratamentului glioblastomului cu temozolomidă? J. Neurochirurgie. 121 , 818–826 (2014).Articol CAS Google Academic
- Hegi, ME, Genbrugge, E., Gorlia, T., Stupp, R., Gilbert, MR, Chinot, OL et al. Limită de metilare a promotorului MGMT cu marjă de siguranță pentru selectarea pacienților cu glioblastom în studiile care omit temozolomida. O analiză comună a patru studii clinice. Clin. Cancer Res . 25 , 1809–1816 (2019).Articol Google Academic
- Herrlinger, U., Tzaridis, T., Mack, F., Steinbach, JP, Schlegel, U., Sabel, M. şi colab. Terapia combinată cu lomustină-temozolomidă versus terapia standard cu temozolomidă la pacienții cu glioblastom nou diagnosticat cu promotor MGMT metilat (CeTeG/NOA-09): un studiu de fază 3, randomizat, deschis. Lancet 393 , 678–688 (2019).Articol CAS Google Academic
- Maroon, J. & Bost, J. Revizuirea beneficiilor neurologice ale fitocanabinoizilor. Surg. Neurol. Int. 9 , 91 (2018).Articol Google Academic
- Pertwee, RG Neurofarmacologia și potențialul terapeutic al canabinoizilor. Dependent. Biol. 5 , 37–46 (2000).Articol CAS Google Academic
- Pertwee, RG In Cannabinoids (ed. Di Marzo V.) pp. 32–83 (Kluwer Academic/Plenum Publishers, New York, SUA, 2004).
- Mechoulam, R. & Hanus, L. Cannabidiol: o privire de ansamblu asupra unor aspecte chimice și farmacologice. Partea I Chim. Asp. Chim. Fiz. Lipide 121 , 35–43 (2012).Articol Google Academic
- Grotenhermen, F. Farmacologia canabinoizilor. Neuro Endocrinol. Lett. 25 , 14–23 (2004).CAS PubMed Google Academic
- Devinsky, O., Cilio, MR, Cross, H., Fernandez-Ruiz, J., French, J., Hill, C. și colab. Canabidiol: farmacologie și potențial rol terapeutic în epilepsie și alte tulburări neuropsihiatrice. Epilepsia 55 , 791–802 (2014).Articol CAS Google Academic
- Schubart, C., Sommer, IE, Fusar-Poli, P., de Witte, L., Kahn, RS & Boks, MP Cannabidiol ca potențial tratament pentru psihoză. EURO. Neuropsihofarmacol. 24 , 51–64 (2014).Articol CAS Google Academic
- Espejo-Porras, F., Fernández-Ruiz, J., Pertwee, RG, Mechoulam, R. și García, C. Efectele motorii ale canabidiolului fitocannabinoid non-psihotrop care sunt mediate de receptorii 5-HT1A. Neurofarmacologie 75 , 155–163 (2013).Articol CAS Google Academic
- Nabissi, M., Morelli, MB, Santoni, M. & Santoni, G. Declanșarea canalului TRPV2 de către canabidiol sensibilizează celulele de glioblastom la agenții chimioterapeutici citotoxici. Carcinogeneza 34 , 48–57 (2013).Articol CAS Google Academic
- Hassan, S., Eldeeb, K., Millns, PJ, Bennett, AJ, Alexander, SP și Kendall, DA Cannabidiolul îmbunătățește fagocitoza microglială prin activarea canalului potențial al receptorului tranzitoriu (TRP). Br. J. Pharmacol. 171 , 2426–2439 (2014).Articol CAS Google Academic
- Brown, KJ, Laun, AS & Song, ZH Cannabidiol, un nou agonist invers pentru GPR12. Biochim. Biophys. Res. comun. 493 , 451–454 (2017).Articol CAS Google Academic
- Kaplan, JS, Stella, N., Catterall, WA & Westenbroek, RE Cannabidiolul atenuează crizele și deficitele sociale într-un model de șoarece al sindromului Dravet. Proc. Natl Acad. Sci. SUA 114 , 11229–11234 (2017).Articol CAS Google Academic
- Laun, AS & Song, ZH GPR3 și GPR6, ținte moleculare noi pentru canabidiol. Biochim. Biophys. Res. comun. 490 , 17–21 (2017).Articol CAS Google Academic
- Pertwee, RG Diversitatea farmacologică a receptorilor CB 1 și CB 2 a trei canabinoizi din plante: Δ9-tetrahidrocannabinol, canabidiol și Δ9 – tetrahidrocannabivarin. Br. J. Pharmacol. 153 , 199–215 (2008).Articol CAS Google Academic
- Lu, HC & Mackie, K. O introducere în sistemul canabinoid endogen. Biol. Psihiatrie 79 , 516–525 (2016).Articol CAS Google Academic
- Ellert-Miklaszewska, A., Ciechomska, I. & Kaminsk, B. Semnalizarea canabinoidelor în celulele gliom. Adv. Exp. Med. Biol. 986 , 209–220 (2013).Articol CAS Google Academic
- Rocha, FC, Dos Santos Júnior, JG, Stefano, SC & da Silveira, DX Revizuirea sistematică a literaturii privind studiile clinice și experimentale privind efectele antitumorale ale canabinoizilor în gliom. J. Neurooncol 116 , 11–24 (2014).Articol CAS Google Academic
- Dimitru, CA, Sandalcioglu, IE & Karsak, M. Cannabinoids in glioblastom therapy: new applications for old drugs. Față. Mol. Neurosci. 11 , 159 (2018).Articol Google Academic
- Torres, S., Lorente, M., Rodríguez-Fornés, F., Hernández-Tiedra, S., Salazar, M., García-Taboada, E. et al. O terapie preclinică combinată cu canabinoizi și temozolomidă împotriva gliomului. Mol. Cancer Ther. 10 , 90–103 (2011).Articol CAS Google Academic
- Guzmán, M., Duarte, MJ, Blázquez, C., Ravina, J., Rosa, MC, Galve-Roperh, I. et al. Un studiu clinic pilot al Delta9-tetrahidrocannabinol la pacienții cu glioblastom multiform recurent. Br. J. Cancer 95 , 197–203 (2006).Articol Google Academic
- Louis, DN, Ohgaki, H., Wiestler, OD, Cavenee, WK, Burger, PC, Jouvet, A. și colab. Clasificarea OMS din 2007 a tumorilor sistemului nervos central. Acta neuropathol. 114 , 97–109 (2007).Articol Google Academic
- Lichtman, AH, Lux, EA, McQuade, R., Rossetti, S., Sanchez, R., Sun, W. şi colab. Rezultatele unui studiu dublu-orb, randomizat, controlat cu placebo, privind spray-ul buco-mucoasa nabiximols ca terapie adjuvantă la pacienții cu cancer avansat cu durere cronică necontrolată. J. Gestionarea simptomelor durerii. 55 , 179–188 (2018).Articol Google Academic
- Fallon, MT, Lux, AE, McQuade, R., McQuade, R., Rossetti, S., Sanchez, R. și colab. Spray oromucoasa Sativex ca terapie adjuvantă la pacienții cu cancer avansat cu durere cronică neatenuată de terapia optimizată cu opioide: două studii de fază 3 dublu-orb, randomizate, controlate cu placebo. Br. J. Pain 11 , 119–133 (2017).Articol Google Academic
- Ballman, KV, Buckner, JC, Brown, PD, Giannini, C., Flynn, PJ, LaPlant, BR și colab. Relația dintre supraviețuirea fără progresie la șase luni și punctele finale de supraviețuire globală la 12 luni pentru studiile de fază II la pacienții cu glioblastom multiform. Neuro Oncol. 9 , 29–38 (2007).Articol CAS Google Academic
- Stupp, R., Brada, M., van den Bent, MJ, Tonn, JC & Pentheroudakis, G., Grupul de lucru privind ghidurile ESMO. Gliom de grad înalt: Ghid de practică clinică ESMO pentru diagnostic, tratament și urmărire. Ann. Oncol. 25 (Suppl 3), iii93–iii101 (2014).Articol Google Academic
- Calculator de prognostic pentru supraviețuirea pacientului cu GBM recurent. http://www.eortc.be/tools/recgbmcalculator/calculator.aspx (2020).
- Norden, AD, Lesser, GL, Drappatz, J., Ligon, KL, Hammond, SN, Lee, EQ și colab. Studiu de fază 2 al temozolomidei cu doză intensă în glioblastomul recurent. Neuro Oncol. 15 , 930–935 (2013).Articol CAS Google Academic
- Stupp, R., Taillibert, S., Kanner, A., Read, W., Steinberg, D., Lhermitte, B. și colab. Efectul câmpurilor de tratare a tumorilor plus temozolomidă de întreținere vs temozolomidă de întreținere în monoterapie asupra supraviețuirii la pacienții cu glioblastom: un studiu clinic randomizat. JAMA 318 , 2306–2316 (2017).Articol CAS Google Academic
Mulțumiri
Suntem datori pacienților care au luat parte la studiu, precum și personalului de la locurile de cercetare clinică. Mulțumim doctorului Marcel Kamp pentru contribuția sa la revizuirea acestui manuscris. Cercetarea a fost susținută de infrastructura Institutului Național de Cercetare în Sănătate (NIHR) din Leeds. Opiniile exprimate sunt ale autorului (autorilor) și nu neapărat ale NHS, NIHR sau Departamentul de Sănătate.
Grupul de studiu GWCA1208
Catherine McBain 6 , Brian Haylock 7 , Paul Mulholland 8 , Christopher Herbert 9 , Allan James 10 , Mohan Hingorani 11 , Joerg Berrouschot 12 , Rainer Fietkau 13 , Jens Panse 14
Informatia autorului
Autori și afilieri
- Institutul de Cercetare Medicală Leeds de la St James’s, Universitatea din Leeds, Leeds, Marea BritanieChris Twelves, Maria Jove și Susan C. Short
- Departamentul de Oncologie, Leeds Teaching Hospitals NHS Trust, St James’s University Hospital, Leeds, Marea BritanieChris Twelves & Susan C. Short
- Departamentul de Neurochirurgie, Universitatea Heinrich-Heine, Dusseldorf, GermaniaMichael Sabel
- GW Research Ltd., Sovereign House, Vision Park, Chivers Way, Histon, Cambridge, Marea BritanieDaniel Checketts, Sharon Miller și Bola Tayo
- Guy’s and St Thomas Hospitals Cancer Centre, Guys Hospital, Great Maze Pond, Londra, Marea BritanieLucy Brazilia
- Departamentul de Oncologie Clinică, The Christie NHS Foundation Trust, Manchester, Marea BritanieCatherine McBain
- The Clatterbridge Cancer Center NHS Foundation Trust, Bebington, Wirral, Marea BritanieBrian Haylock
- Spitalul University College, Londra, Marea BritaniePaul Mulholland
- Spitalele universitare Bristol NHS Foundation Trust, Bristol, Marea BritanieChristopher Herbert
- Cancer Research UK CTU, Beatson West of Scotland Cancer Centre, Glasgow, Marea BritanieAllan James
- Hull și East Yorkshire NHS Trust, Spitalul Castle Hill, Cottingham, Marea BritanieMohan Hingorani
- Departamentul de Neurologie, Klinikum Altenburger Land GmbH, Altenburg, GermaniaJoerg Berrouschot
- Strahlenklinik, Universitätsklinikum Erlangen, Erlangen, GermaniaRainer Fietkau
- Clinica de Hematologie și Oncologie, Universitätsklinikum Aachen, Aachen, GermaniaJens Panse
Consorții
în numele grupului de studiu GWCA1208
- Catherine McBain
- , Brian Haylock
- , Paul Mulholland
- , Christopher Herbert
- , Allan James
- , Mohan Hingorani
- , Joerg Berrouschot
- , Rainer Fietkau
- și Jens Panse
Contribuții
Implicat în analiză, interpretarea datelor studiului, a contribuit la scrierea și revizuirea manuscrisului: SM, BT, DCDC a fost responsabil pentru analiza statistică. Implicat în achiziționarea datelor din studiu, interpretarea datelor din studiu și a contribuit la scrierea și revizuirea manuscrisului: SS, MS, MJ, LB și CT
autorul corespunzator
Declarații de etică
Aprobarea etică și acordul de participare
Acest studiu a fost realizat în conformitate cu ghidurile de bune practici clinice ale Consiliului Internațional pentru Armonizare și principiile etice care își au originea în Declarația de la Helsinki. Protocolul de cercetare a fost aprobat de Consiliul de revizuire instituțional relevant sau de Comitetul de etică independent de la fiecare locație, inclusiv: Comitetul NRES Yorkshire și The Humber—Leeds East. Comitetul de etică al Asociației Medicale de Stat din Turingia în consultare cu: Comitetul de etică al lui Friedrich-Alexander de la Universitatea din Erlangen-Nürnberg. Comitetul de etică al Facultății de Medicină a Universității din Duesseldorf. Comisia de etică a Facultății de Medicină din cadrul Colegiului Tehnic Rheinisch-Westfälischen, Aachen. Toți pacienții au furnizat consimțământul informat în scris.
Disponibilitatea datelor
Protocolul de studiu este înregistrat pe site-ul web ClinicalTrials.gov (Partea 1: NCT01812603; Partea 2: NCT01812616). Materialele suplimentare conțin informații suplimentare despre site-ul individual și regulile de oprire ale pacientului, echipa de evaluare a siguranței, analiza farmacocinetică, metode statistice, randomizare, pacienți excluși din analiza farmacocinetică și scanări cu imagistica prin rezonanță magnetică. Caracteristicile demografice și de referință sunt rezumate în Tabelul suplimentar 1 . Toxicitățile maxime ale evenimentelor adverse apărute la tratament pentru pacienții care au prezentat un eveniment advers de grad 2 sau mai mare sunt rezumate în Tabelul suplimentar 2 . Supraviețuirea globală estimată de EORTC vs. reală pentru elementul randomizat al studiului este rezumată în Tabelul suplimentar 3 . Supraviețuirea globală estimată de EORTC versus supraviețuirea globală reală pentru elementul deschis al studiului este rezumată în Tabelul suplimentar 4 . Parametrii farmacocinetici pentru temozolomidă și 4-amino-5-imidazol-carboxamidă din elementul deschis al studiului sunt rezumați în Tabelul suplimentar 5 . Parametrii farmacocinetici pentru temozolomidă și 4-amino-5-imidazol-carboxamidă din elementul randomizat al studiului sunt rezumați în Tabelul suplimentar 6 . Schema de încercare este furnizată în Fig. 1 suplimentară .
Interese concurente
DC, SM și BT sunt angajați de și dețin opțiuni pe acțiuni la GW. CT, MS, MJ, LB și SS nu au conflicte de interese de declarat.
Informații de finanțare
Studiul a fost sponsorizat de GW Research Ltd (GW). Sprijin pentru redactarea medicală a fost oferit autorilor de către Lesley Taylor, PhD, de la Alchemy Medical Writing Ltd. și finanțat de Greenwich Biosciences, Inc. GW a oferit finanțare programului de burse clinice a Spitalului Leeds, care a susținut bursa MJs. Societatea Spaniolă de Oncologie Medicală a acordat un grant personal lui MJ
Informații suplimentare
Nota editorului Springer Nature rămâne neutră în ceea ce privește revendicările jurisdicționale în hărțile publicate și afilierile instituționale.
Informatie suplimentara
Material suplimentar
Drepturi și permisiuni
Acces deschis Acest articol este licențiat în baza unei licențe internaționale Creative Commons Attribution 4.0, care permite utilizarea, partajarea, adaptarea, distribuirea și reproducerea în orice mediu sau format, atâta timp cât acordați un credit corespunzător autorilor originali și sursei, furnizați un link către licența Creative Commons și indicați dacă s-au făcut modificări. Imaginile sau alte materiale ale terților din acest articol sunt incluse în licența Creative Commons a articolului, cu excepția cazului în care se indică altfel într-o linie de credit a materialului. Dacă materialul nu este inclus în licența Creative Commons a articolului și utilizarea dorită nu este permisă de reglementările legale sau depășește utilizarea permisă, va trebui să obțineți permisiunea direct de la deținătorul drepturilor de autor. Pentru a vedea o copie a acestei licențe, vizitați http://creativecommons.org/licenses/by/4.0/ .
Despre acest articol
Citează acest articol
Twelves, C., Sabel, M., Checketts, D. et al. Un studiu randomizat de fază 1b, controlat cu placebo, cu spray oromucozic canabinoid nabiximol cu temozolomidă la pacienții cu glioblastom recurent. Br J Cancer 124 , 1379–1387 (2021). https://doi.org/10.1038/s41416-021-01259-3
- Primit02 iulie 2020
- Revizuit10 decembrie 2020
- Admis05 ianuarie 2021
- Publicat24 februarie 2021
- Data emiterii12 aprilie 2021
- DOIhttps://doi.org/10.1038/s41416-021-01259-3
Distribuie acest articol
Oricine căruia îi partajați următorul link va putea citi acest conținut:Obțineți un link care poate fi partajat
Furnizat de inițiativa Springer Nature SharedIt de partajare a conținutului
Subiecte
Acest articol este citat de
- Un studiu randomizat de fază II cu temozolomidă cu sau fără canabinoizi la pacienții cu glioblastom recurent (ARISTOCRAT): protocol pentru un studiu multicentric, dublu-orb, controlat cu placebo
- Divyalakshmi Bhaskaran
- Joshua Savage
- Susan C. Scurt
- Rigiditatea matricei afectează polarizarea funcțională a macrofagelor asociată tumorii și potențialul său în terapia tumorală
- Jiaqiang Xiong
- Rourou Xiao
- Meng Wu
- Sprijinirea sănătății intestinale cu canabis medicinal la persoanele cu cancer avansat: beneficii potențiale și provocări
- Hannah R. Wardill
- Luke T. Wooley
- Timothy J. Price
- Ghid MASCC: canabis pentru durerea asociată cancerului și riscul de vătămări și evenimente adverse
- Josephine To
- Mellar Davis
- Jessica Garsed
- Efectele terapeutice și de susținere ale canabinoizilor la pacienții cu tumori cerebrale (ulei CBD și canabis)
- J. Eduardo Rodriguez-Almaraz
- Nicolae Butowski