Scopul acestui studiu retrospectiv este de a evalua ratele de răspuns tumoral și profilurile de toxicitate ale terapiei cu IL-2 într-o cohortă mai contemporană de pacienți cu melanom metastatic și antecedente de metastaze cerebrale.
Abstract
Scop : Terapia cu doze mari de interleukină-2 (IL-2) are ca rezultat răspunsuri rare, dar durabile în melanomul metastatic (MM); cu toate acestea, utilizarea sa la pacienții cu metastaze cerebrale (BM) a fost controversată din cauza preocupărilor legate de siguranță și a datelor limitate privind eficacitatea la această populație. Scopul acestui studiu retrospectiv este de a evalua ratele de răspuns tumoral și profilurile de toxicitate ale terapiei cu IL-2 într-o cohortă mai contemporană de pacienți cu MM și antecedente de BM.
Pacienți și metode : Un total de 320 de pacienți care au primit terapie cu IL-2 cu MM în stadiul III sau IV au fost incluși într-o bază de date colectată prospectiv. La momentul intrării în studiu, 38 de pacienți aveau antecedente de BM, dintre care 35 primiseră tratament anterior pentru BM, care era în principal radioterapie. A fost efectuată o analiză post-hoc a supraviețuirii globale folosind curbele Kaplan-Meier (KM), precum și ratele de răspuns tumorale, numărul de cicluri de terapie finalizate și profilul de toxicitate pe ciclu și sistem de organe. Cei 282 de pacienți din baza de date fără BM au servit ca populație de control.
Rezultate : Intervalul mediu de la diagnosticarea BM până la începerea terapiei cu HD-IL2 a fost de 3,1 luni (interval: 0,39 până la 13,5). Urmărirea mediană (mFU) a fost de 22,0 luni. Supraviețuirea globală mediană (mOS) la pacienții cu MM cu BM (n=38) a fost de 12,2 luni, față de 19,4 luni la acei pacienți fără BM (n=282) (p=0,23). Din cei 38 de pacienți cu BM, 34 (89,5%) au fost evaluabili pentru răspuns la HD-IL2. Rata de răspuns a fost de 11,8%, comparativ cu o rată de răspuns de 14,0% la subiecții fără BM. Un pacient (2,9%) a obținut răspuns complet (CR), 3 pacienți (8,8%) au obținut răspuns parțial (PR) și 8 pacienți (23,5%) au avut boală stabilă (SD). Ciclul de tratament cu IL-2 a fost încheiat din cauza toxicității la majoritatea pacienților din ambele cohorte, iar sistemele cel mai frecvent afectate au fost cardiace, renale, neurologice și gastrointestinale. Toxicitatea neurologică care limitează tratamentul a fost observată la 12,1% dintre pacienții cu antecedente de BM și 13,2% dintre pacienții fără BM în timpul ciclului 1.
Concluzie : Aceasta este cea mai mare analiză raportată până în prezent a tratamentului cu IL-2 la pacienții cu antecedente de BM. IL-2 a fost bine tolerată în această cohortă și rata complicațiilor neurologice a fost similară cu grupul de control. Rata de răspuns și supraviețuirea mediană sunt comparabile cu cele observate la pacienții fără antecedente de BM. IL-2 este sigură și are activitate terapeutică la pacienții cu melanom cu antecedente de BM tratată.
Introducere
Melanomul este în creștere în incidență cu aproximativ 10.000 de decese anual în Statele Unite. Morbiditatea și mortalitatea considerabile din cauza melanomului sunt legate de potențialul bolii de a metastaza în toate locațiile corpului. Metastazele la nivelul sistemului nervos central (SNC) sunt deosebit de problematice, deoarece pot fi asociate cu simptome clinice semnificative și mortalitate precoce legată de boală. Aproape 40% dintre pacienții cu melanom în stadiul IV dezvoltă metastaze cerebrale (BM), dar acest lucru poate subestima prevalența, deoarece 55% până la 75% dintre pacienții care au murit din cauza melanomului s-au dovedit a avea BM la autopsie. 1-6 În ciuda tratamentelor moderne, cum ar fi radiochirurgia stereotactică, supraviețuirea globală mediană (SG) la pacienții cu MM cu metastaze cerebrale este de aproximativ 6 până la 9 luni. 1,7 Scorul de performanță Karnofsky, precum și numărul de BM sunt factori cheie de prognostic în MM și pot fi utilizați pentru a stratifica pacienții în grupuri cu un interval mOS de 3,4 luni până la 13,2 luni cu sistemul de scoring Graded Prognostic Assessment (GPA). 8 LDH anormală s-a dovedit, de asemenea, a fi un marker de prognostic slab la pacienții cu MM cu BM. 9
Pilonul terapiei pentru melanomul BM a fost o abordare localizată constând în mare parte din radiații stereotactice și craniotomie cu extirparea tumorii, atunci când este posibil. Majoritatea chimioterapiei sistemice, cum ar fi dacarbazina, nu traversează bariera hemato-encefalică. Unii pacienți au fost tratați cu temozolomidă, un agent alchilant care intră în SNC, dar nu a fost asociat cu o supraviețuire îmbunătățită la pacienții cu MM. 10 Terapiile mai noi, cum ar fi ipilimumab, au demonstrat activitate la pacienții cu MM cu BM și se crede că acest lucru se datorează, cel puțin parțial, activării periferice a celulelor T, care sunt capabile să intre și să exercite un efect antitumoral în SNC. 11,12 În plus, inhibitorii BRAF precum vemurafenib și dabrafenib au demonstrat activitate împotriva BM, dabrafenib demonstrând o rată de răspuns intracranian de 39%. 13 Acești noi agenți au adus la iveală o abordare multidisciplinară a tratamentului melanomului BM care implică oncologia medicală, oncologia radiațiilor și neurochirurgia.
Doza mare de interleukina-2 (IL-2) este asociată în mod constant cu o rată de răspuns de 17% până la 20% și cu o supraviețuire mediană fără progresie (PFS) de 13 luni la cei care au răspuns la terapie. 8,14-17 Utilizarea IL-2 a fost adesea limitată la pacienții fără metastaze cerebrale din cauza îngrijorărilor că ar duce la o toxicitate mai mare din cauza edemului cerebral din sindromul de scurgere capilară și eficacitate redusă datorită privilegiului imunologic al SNC. 18
Spre deosebire de aceste preocupări, mai multe studii mici au arătat rezultate favorabile cu tratamentul cu IL-2 al pacienților cu BM din melanom metastatic. 1,9,15,19 Aceste studii au sugerat un profil de toxicitate similar la cei cu și fără BM. Într-un studiu, 7 pacienți cu boală în stadiul IV s-au dovedit a avea BM, iar 1 a prezentat un răspuns parțial după rezecția chirurgicală a unei leziuni cerebrale solitare. Dintr-un total de 8 pacienți, 1 a fost observat a avea toxicitate neurologică, care s-a considerat a fi secundară sevrajului de alcool, mai degrabă decât tratamentului cu IL-2. 15 Un alt studiu a demonstrat că 2 pacienți cu BM au avut un răspuns tumoral intracranian; 1 a arătat un răspuns mixt și 1 a arătat un răspuns complet; acest pacient a avut radiații creierului întreg și vaccinare polivalentă înainte de IL-2. A fost raportat 1 eveniment neurologic advers din 15 pacienți, care a fost caracterizat drept confuzie. 19 Un studiu de fază III de tratament cu IL-2 cu doze mari a arătat o creștere a toxicității și a ratei de răspuns în comparație cu IL-2 în doză mică, atunci când pacienții erau stratificați pentru metastaze osoase și hepatice, dar nu BM. 20
Această revizuire a fost întreprinsă pentru a evalua mai bine potențiala eficacitate și toxicitate asociate cu terapia cu doze mari de IL-2 în epoca contemporană. O bază de date colectată retrospectiv și prospectiv, P roleukin® Registrul observațional pentru evaluarea tiparelor de tratament și a răspunsului clinic în afecțiunile maligne (PROCLAIM SM ), a fost înființat în 2011. 21 Aceasta este cea mai mare bază de date IL-2 și conține date demografice, clinice și de rezultat privind pacienții cu MM care primesc IL-2. la 35 de centre medicale academice și comunitare diferite. Baza de date a fost accesată pentru a determina rezultatele tratamentului și profilurile evenimentelor adverse la pacienții cu MM cu BM tratați cu IL-2 în doză mare.
Metode
Populația de pacienți
Datele au fost colectate din baza de date observațională PROCLAIM. Pentru a fi incluși în cohorta prospectivă a registrului, pacienții trebuie să semneze formulare de consimțământ informat, să fi avut cel puțin 18 ani și să fi primit un curs inițial (2 cicluri) de IL-2. Pacienții care au primit mai mult de 1 curs de IL-2 și/sau au fost deja supuși unei scanări post-tratament nu au fost eligibili pentru înscriere, pentru a controla prejudecățile rezultate din rezultatele scanării. Pentru pacienții care au raportat BM, site-urile au fost interogate pentru data diagnosticului BM și toate tratamentele pentru BM. Au fost adunate caracteristicile inițiale privind sexul, vârsta, stadializarea tumorii, starea de performanță ECOG, subtipul melanomului, testarea mutațiilor, precum și LDH pre-tratament. Numărul de BM per pacient și utilizarea steroizilor nu au fost capturate în baza de date. Toate site-urile trebuiau să aibă aprobarea de către consiliile lor de revizuire instituționale (IRB) respective înainte de înscrierea subiectului.
Tratament și evaluări
Toți pacienții au fost tratați cu IL-2 conform indicațiilor clinice; pacienților li s-a administrat o doză de 600.000 până la 720.000 UI/kg IV în bolus la fiecare 8 ore în zilele 1 până la 5 (ciclul 1) și zilele 15 până la 19 (ciclul 2) cu un maxim de 28 de doze pe ciclu în două cicluri. 22 A fost înregistrat numărul total de cicluri și doze de IL-2 primite de fiecare pacient. Răspunsul tumoral la IL-2 a fost capturat prin imagistica compartimentelor extracraniene și intracraniene la 4 până la 6 săptămâni după finalizarea unui curs de IL-2. Evaluarea răspunsului tumorii a fost determinată de investigatorul care a tratat folosind fie criteriile RECIST, fie criteriile OMS, conform procedurii standard ale site-ului.
A fost înregistrat motivul încheierii ciclului; motivele potențiale au inclus completarea dozelor planificate, toxicitatea, preferința pacientului, decesul etc. Dacă toxicitatea a fost dată ca motiv pentru încheierea ciclului, locul ar putea enumera până la 3 sisteme diferite (adică, cardiac, neurologic, renal etc.) și s-a notat toxicitatea specifică în cadrul fiecărui sistem. De exemplu, o toxicitate neurologică ar putea fi clasificată în continuare ca agitație, confuzie, psihoză și nu este specificată altfel. Datele de supraviețuire globală au fost măsurate de la începutul tratamentului cu IL-2 până la data decesului pacientului sau la data urmăririi. S-a înregistrat cauza morții.
Analize statistice
Analiza a fost efectuată din datele care au fost blocate pe 24 septembrie 2015. Au fost furnizate statistici descriptive pentru caracteristicile de referință. Timpul de urmărire a fost măsurat de la data de începere a IL-2 până la data morții sau data ultimei urmăriri. Metoda lui Kaplan și Meier a fost utilizată pentru a obține curbele de supraviețuire, mOS și rate de supraviețuire cu intervale de încredere corespunzătoare de 95% și a fost comparată folosind testul log-rank. Testele de asociere pentru variabile categorice au folosit testul Chi pătrat și, având în vedere dimensiunea mică a eșantionului, testul exact Fisher a fost utilizat atunci când a fost necesar. Testul t cu două eșantioane a fost utilizat la testarea unei asocieri între mediile grupului pentru variabilele continue. Pe parcursul analizei, valorile p <0,05 au fost considerate semnificative statistic. Toate calculele statistice au fost efectuate folosind SAS 9.4.
Rezultate
Populația de pacienți
Dintre pacienții din cohorta prospectivă diagnosticați cu melanom metastatic (N=320), pacienții cu BM la momentul inițial (n=38) au fost identificați față de pacienții fără BM la momentul inițial (n=282). TABELUL 1 oferă statistici descriptive pentru datele demografice ale pacienților. Din cei 320 de pacienți identificați, 123 (38,4%) erau femei, iar restul bărbați. Vârsta medie a fost de 53 de ani (interval, 21-84) și 271 (84,7%) aveau mai puțin de 65 de ani, 49 (15,3%) aveau peste 65 de ani. Starea de performanță ECOG a fost 0 din 221 (69,1%), 1 din 90 (28,1%) și 2 din 3 (1%) dintre pacienți. Nu au existat diferențe în ceea ce privește vârsta, sexul sau starea de performanță ECOG a pacienților din cohorta BM comparativ cu cohorta non-BM. În timp ce definiția BM plasează toți pacienții în stadiul IV M1c, grupul non-BM a avut, de asemenea, un număr mare de pacienți în stadiul IV M1c (120; 37,5%). Majoritatea pacienților din ambele cohorte au fost raportate a avea niveluri crescute de LDH înainte de a începe IL-2 (82,8% pentru grupul BM și 67,8% pentru grupul non-BM; P = 0,39).
Intervalul mediu de la diagnosticul inițial până la diagnosticul de BM a fost de 34,9 luni (min: 0,03, max: 176). Din cei 37 de pacienți cu date complete disponibile, au fost 7 (18,9%) care au fost diagnosticați cu BM în primul an de diagnostic inițial de cancer. Doi dintre acești 7 pacienți au fost diagnosticați cu boală metastatică la momentul prezentării inițiale. Intervalul mediu de la diagnosticarea BM până la începerea terapiei cu HD-IL2 a fost de 3,1 luni (min: 0,39, max: 13,5). Nouă (24,3%) dintre acești pacienți au început HD-IL2 în decurs de o lună sau mai puțin de la diagnosticarea cu BM.
Din cei 38 de pacienți cu BM, toți pacienții cu excepția 3 (7,89%) au primit tratament local pentru BM înainte de a începe HD-IL2. A existat 1 pacient care nu a primit niciun tratament oncologic anterior înainte de a începe HD-IL2. Dintre cei 35 de pacienți cu BM care au primit tratament anterior pentru metastaze cerebrale, 32 au primit o formă de radioterapie – 27 au avut radiochirurgie stereotactică și 6 pacienți au primit radioterapie pe tot creierul (WBRT). Cinci pacienți au suferit rezecție chirurgicală pentru BM.

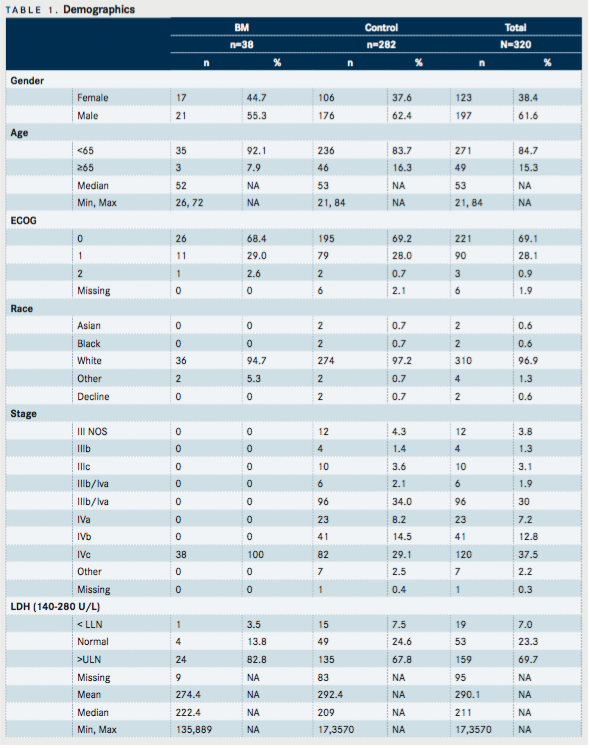
Răspunsul tumoral
Răspunsul tumoral la IL-2 a fost disponibil pentru 34 din cei 38 de pacienți (89,5%) din grupul BM și 272 din cei 282 de pacienți (96,5%) din grupul de control. În populația de control, rata de răspuns obiectiv (ORR) a fost de 14% (7 [2,6%] răspuns complet și 31 [11,4%] răspuns parțial, TABEL 2A ). Alți 78 de pacienți au avut SD (28,7%) pentru o rată de control al bolii (DCR) de 42,7% ( TABELUL 2B ). În schimb, pacienții cu BM au avut un ORR de 11,8% (1 CR [2,9%] și 3 PR [8,8%], TABEL 2A ) Alți 8 (23,5%) pacienți au fost stabili pentru un DCR de 35,2% ( TABEL 2B ) . Folosind testul exact al lui Fisher, nu a existat o relație semnificativă statistic între cele 2 grupuri în ceea ce privește ORR (P = 1) sau DCR (P = 0,4645, TABEL 2 ). Pacienta care a obținut un răspuns complet a fost diagnosticată cu melanom metastatic la creier și intestin în iunie 2011. BM ei a fost tratată cu radiochirurgie stereotactică, urmată imediat de un tratament scurt pe protocol cu vaccin MAGE-3. Apoi a primit 2 cicluri de terapie cu IL-2 în septembrie și octombrie 2011 și a obținut un RC la primele ei scanări CT și RMN de restabilire. Ea rămâne în viață peste 4 ani și nu a primit nicio terapie ulterioară.

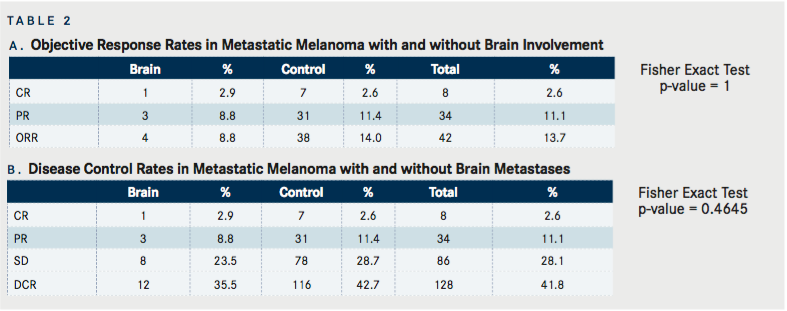
Numărul de doze de IL-2 administrate
Numărul total de doze de IL-2 primite de pacienţi pe întreaga durată a tratamentului cu IL-2 a fost calculat pentru toţi pacienţii ( TABELUL 3 ). În grupul BM (n=38) numărul mediu de doze totale primite a fost de 20,6 (IC 95%: 16,6, 24,5), pacienții de control (n=282) au avut o medie de 24,0 doze totale (IC 95%: 22,4, 25.5), nu a existat nicio diferență semnificativă statistic între cele două grupuri.

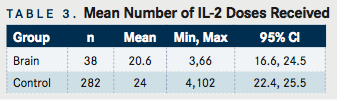
Profil de toxicitate
Evenimentele adverse observate sunt prezentate de către sistemul de organe pentru Ciclul 1 al tratamentului cu IL-2 în FIGURA 1A . În general, nu au existat diferențe semnificative în grupurile BM și de control în ceea ce privește proporția de toxicitate în funcție de sistemul de organe. În timpul ciclului 1, 21,1% dintre pacienții cu BM au întrerupt terapia cu IL-2 în întregime sau parțial din cauza neurotoxicității, inclusiv 1 pacient care a murit din cauza edemului cerebral și a herniei cerebrale. Niciun pacient nu a murit în timpul terapiei din grupul de control. În grupul de control, 16,7% dintre pacienți au întrerupt tratamentul cu IL-2 în întregime sau parțial din cauza neurotoxicității. În timpul ciclului 2, 25,8% dintre pacienții cu BM și 22,1% dintre pacienții de control au întrerupt ciclul integral sau parțial din cauza neurotoxicității. Neurotoxicitatea ( FIGURA 1B ) a fost împărțită în agitație, confuzie, psihoză și altele. În grupul BM, neurotoxicitățile din ciclul 1 au fost raportate ca 1 caz de vise vii, 1 caz de agitație, 2 cazuri de confuzie și 3 cazuri de oboseală. Neurotoxicitățile din grupul BM din ciclul 2 au fost raportate ca 2 cazuri de confuzie, 2 cazuri de psihoză, 1 caz de encefalopatie acută, 2 de oboseală mentală și 1 de slăbiciune. Nu au fost raportate modificări senzoriale, convulsii sau comă în grupul BM.
Analiza supraviețuirii
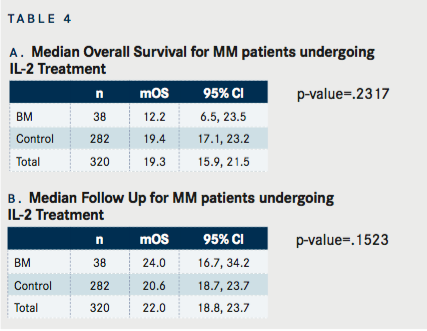
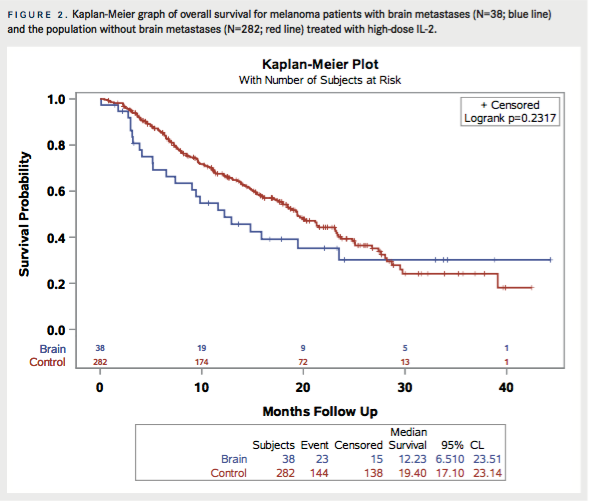
În ambele grupuri, puțin peste jumătate dintre pacienți au fost raportați decedați la momentul ultimei urmăriri, 60,5% pentru pacienții cu BM și 51,1% pentru pacienții fără BM. MOS pentru toți pacienții a fost de 19,3 luni (IC 95%: 15,9, 21,5) ( TABELUL 4A ) și timpul median de urmărire a fost de 22 luni (IC 95%: 18,8, 23,7) ( TABEL 4B ). MOS pentru pacienții cu BM a fost de 12,2 luni (IC 95%: 6,5, 23,5) și 19,4 luni (IC 95%: 17,1, 23,2) pentru pacienții fără BM, care nu a fost semnificativ diferit (P = 0,23). La 1 an, rata de supraviețuire pentru pacienții cu BM a fost de 51,8% (IC 95%: 34,2, 66,7) iar pentru pacienții fără BM rata de supraviețuire la 1 an a fost de 67,6% (IC 95%: 61,4, 72,9). Riscul de deces a fost inițial mai mic în grupul de control, dar după 20 de luni de urmărire a existat o încrucișare a curbelor de supraviețuire Kaplan-Meier ( FIGURA 2 ); trecut de acel moment, pacienții cu BM au avut un risc de deces mai mic decât cei fără BM.
Pentru grupul BM a existat o relație semnificativă statistic între răspunsul tumoral și mOS (P = 0,0065) ( TABELUL 2A ). MOS nu a fost atins pentru pacienții cu răspuns complet (n=1) sau boală stabilă (n=8). Pacienții cu răspuns parțial au avut un mOS de 19,5 luni (IC 95%: 2,99, neevaluabil [NE]), iar pacienții care au raportat boală progresivă au avut un mOS de 9,2 luni (IC 95%: 3,88, 12,92). Pentru grupul de control ( TABELUL 4B ) a existat o relație semnificativă statistic între răspunsul tumorii și mOS (P <.0001). MOS pentru pacienții cu răspuns complet (n=7) nu a fost atins. Pacienții cu PR (n=31) au avut un mOS de 23,3 (95%CI: 17,1, NE), iar pacienții cu SD (n=78) au avut un mOS de 26,8 luni (95%CI: 21,3, NE) și pacienții cu progresie boala (n=156) a avut un mOS de 13,7 (IC 95%: 10,29, 17,59).


Discuţie
Dezvoltarea BM a fost asociată istoric cu rezultate sumbre pentru pacienții cu melanom. Tratamentul cu doze mari de IL-2 a fost considerat contraindicat la astfel de pacienți din cauza îngrijorărilor cu privire la edemul intracerebral secundar sechestrului de lichid în spațiul trei indus de IL-2. Având în vedere prognosticul general prost pentru astfel de pacienți și excluderea generală a pacienților cu metastaze la SNC din studiile clinice, beneficiul clinic real al IL-2 la pacienții care sunt diagnosticați cu BM rămâne în mare parte necunoscut. Într-un raport anterior, a fost raportată o ORR de 5,6% cu IL-2 în doză mare la pacienții cu BM netratate anterior. Autorii au concluzionat că IL-2 ar putea fi sigură și adecvată la pacienții cu melanom foarte selectați. În epoca actuală, multe lucruri s-au schimbat, inclusiv sensibilitatea îmbunătățită a tehnicilor imagistice, utilizarea în creștere a radiochirurgiei stereotactice pentru oligometastaze, progresul în terapia țintită și imunoterapia în melanom și un management mai bun al pacienților cu IL-2 în doză mare. Astfel, am căutat să determinăm atât profilul de siguranță, cât și beneficiul clinic al IL-2 într-o epocă mai contemporană.
Folosind o bază de date IL-2 modernă, colectată prospectiv, am identificat 38 de pacienți cu BM la diagnosticul inițial din 320 de pacienți cu melanom înrolați secvenţial. Numărul mediu de doze de IL-2 a fost similar între cele două cohorte (20,6 vs. 24; vezi TABELUL 3 ). În această serie, dintre cei 38 de pacienți cărora li sa administrat IL-2 în doză mare, a fost observată o ORR de 11,8%, iar aceasta a inclus o rată de răspuns complet de 2,9% din populație. Aceste rate sunt mai apropiate de ratele de răspuns obiectiv raportate de 16% până la 17% pentru pacienții cu melanom metastatic care primesc IL-2 fără BM. 17,23 Astfel, cel puțin la pacienții selectați, IL-2 în doză mare pare să aibă activitate la pacienții cu melanom BM.
Un alt argument împotriva IL-2 este că un grad mai mare de neurotoxicitate poate fi asociat cu tratamentul. Deși a existat 1 deces neurologic probabil legat de tratament în grupul BM, nu au existat alte diferențe notabile în tipul, frecvența sau intensitatea evenimentelor adverse între pacienții cu melanom cu și fără BM, indiferent de numărul ciclului sau sistemul de organe. Toxicitatea cel mai frecvent raportată care a condus la întreruperea tratamentului cu IL-2 s-a datorat toxicității cardiace sau renale cu rate comparabile la pacienții cu și fără BM ( FIGURA 1 ). Neurotoxicitatea a fost al treilea cel mai frecvent motiv pentru oprirea tratamentului cu IL-2, dar ratele au fost aproximativ similare în ambele grupuri. A existat o rată mai mare de evenimente adverse gastrointestinale la pacienții fără BM în toate ciclurile care au fost incluse în analiză. Am încercat să distingem dacă prezența BM ar putea fi asociată cu o prezentare diferită a neurotoxicității. Deși am observat o incidență puțin mai mare a agitației la cei cu BM, incidența confuziei a fost de fapt mai mică la pacienții cu BM. Aceste diferențe au fost minime și probabil sugerează că evenimentele adverse neurologice, deși nu sunt rare la pacienții cărora li se administrează IL-2, nu sunt semnificativ diferite la pacienții cu BM. Pe baza acestor rezultate, nu pot fi făcute recomandări specifice pentru monitorizarea preferențială a pacienților cu BM tratați cu IL-2 în doză mare.
În acest studiu, supraviețuirea globală mediană a fost de 12,2 luni pentru pacienții cu BM, comparativ cu 19,4 luni pentru cei fără BM (P = 0,237). Deși rata de supraviețuire la 1 an a fost numeric mai mică în grupul BM decât în grupul de control (51,8% față de 67,6%, respectiv), rata de supraviețuire la 3 ani în grupul BM a fost de fapt mai mare decât grupul de control (30,2% față de 24,2 %, respectiv). Aceste date sugerează că supraviețuirea pe termen lung este posibilă indiferent de prezența bolii SNC. În plus, supraviețuirea globală mediană de 12,2 luni este mai mare decât supraviețuirea globală mediană raportată în alte serii publicate de pacienți cu melanom cu metastaze cerebrale. 24,25 Deși este interesant de speculat că controlul bolii SNC cu IL-2 poate preveni ulterioare SNC și metastazele hematogene ale melanomului, această ipoteză necesită o confirmare suplimentară.
Acest studiu are câteva limitări importante, inclusiv potențialul de părtinire a selecției, deoarece populația a fost derivată din centrele experți de IL-2, natura retrospectivă a revizuirii și lipsa unei cohorte randomizate. În plus, acest studiu a inclus o mulțime de pacienți mai tineri și bărbați, în special în grupul cu metastaze cerebrale, ceea ce poate limita, de asemenea, capacitatea de a generaliza rezultatele. Am încercat să evaluăm câțiva factori importanți de stratificare a riscului, cum ar fi starea de performanță și nivelurile serice de LDH pentru a defini mai bine cele două cohorte. În populația totală, LDH seric a fost crescută la 159 (69,7%) dintre pacienții cu niveluri ușor mai mari din grupul cu BM (82,8%) comparativ cu pacienții fără BM (67,84%). Starea de performanță ECOG a fost de 1 la 2 la 31,6% dintre pacienții cu BM comparativ cu 28,72% dintre acei pacienți fără BM. Au existat pacienți puțin mai tineri în grupul BM (92,1% < 65 de ani) comparativ cu grupul de control (83,7% < 65 de ani). Astfel, grupurile par să fie relativ bine potrivite în ceea ce privește starea de performanță și LDH, dar a existat un număr ușor mai mare de pacienți mai tineri în grupul BM. Un raport recent a demonstrat răspunsuri clinice comparabile cu evenimente adverse mai mici la pacienții în vârstă, astfel încât impactul vârstei este mai puțin sigur la această populație (26). În cele din urmă, în timp ce baza de date reprezintă o resursă utilă, există anumite date care nu au fost colectate care pot fi importante, cum ar fi numărul de BM la fiecare pacient și tipul de tratament direcționat către creier.

Impactul imunoterapiei asupra tratamentului melanomului a fost semnificativ în ultimii 5 ani, cu un număr tot mai mare de agenți eficienți disponibili. Progresele cu inhibitori ai punctelor de control ale celulelor T care vizează CTLA-4 și PD-1 sunt deosebit de interesante și studiile timpurii au sugerat activitate în SNC cu acești agenți. 11,27 Acest raport se adaugă altora care sugerează activitate cu IL-2 în doză mare și, prin urmare, imunoterapia în general poate fi o alternativă adecvată pentru pacienții cu boală SNC. Disponibilitatea unor agenți noi și eficienți pentru pacienții cu melanom oferă noi provocări clinice în proiectarea planurilor de tratament. În ciuda progreselor, mulți pacienți nu răspund la medicamentele individuale, poate apărea rezistență și este necesară înțelegerea impactului potențial al fiecărei abordări. Aceasta este cea mai mare analiză raportată până în prezent a tratamentului cu doze mari de IL-2 la pacienții cu antecedente de BM. Deși dimensiunea eșantionului este mică și există câteva limitări ale studiului, aceste date demonstrează că IL-2 în doză mare are eficacitate terapeutică la pacienții cu melanom cu BM și tratamentul este asociat cu un profil de siguranță acceptabil. Dozele mari de IL-2 ar trebui să fie luate în continuare cu atenție la pacienții cu melanom adecvate chiar și în prezența BM. Rezultatele susțin investigațiile clinice suplimentare ale IL-2 cu doze mari în monoterapie și în combinație pentru această cohortă cu risc ridicat de pacienți cu melanom. Mai larg, aceste date determină reconsiderarea excluderii generale a pacienților cu BM de la tratamentul cu IL-2 comercial sau din studiile clinice bazate pe IL-2.
Referințe
- Fife K, Colman M, Stevens G și colab. Determinanți ai rezultatului la pacienții cu melanom cu metastaze cerebrale. JCO . 2004;22:1293-1300.
- Johnson JD, Young B. Demografia metastazelor cerebrale. Neurosurg Clin N Am . 1996; 7(3): 337-344.
- Staudt M, Lasithiotakis K, Leiter U, et al. Determinanți ai supraviețuirii la pacienții cu metastaze cerebrale din melanom cutanat. Br J Cancer . 2010;102(8):1213-1218. doi:10.1038/sj.bjc.6605622.
- Fonkem E, Uhlmann EJ, Floyd SR, et al. Metastaza cerebrală a melanomului: prezentare generală a managementului actual și a terapiilor țintite emergente. Expert Rev Neurother . 2012; 12(10): 1207-1215.
- Barnholtz-Sloan JS, Sloan AE, Davis FG și colab. Proporțiile de incidență a metastazelor cerebrale la pacienții diagnosticați (1973 până în 2001) în sistemul metropolitan de supraveghere a cancerului din Detroit. JCO . 2004;22(14): 2865-2872.
- Schouten LJ, Rutten J, Huveneers HA, et al. Incidența metastazelor cerebrale la o cohortă de pacienți cu carcinom de sân, colon, rinichi, plămâni și melanom. Rac . 2002;94(10):2698-2705.
- Frakes JM, Figura ND, Ahmed KA, et al. Rolul potențial al radiochirurgiei stereotactice bazate pe LINAC pentru tratamentul a 5 sau mai multe metastaze cerebrale radiorezistente. JNS . 2015;123(5):1261-1267.
- Sperduto PW, Kased N, Roberge D, et al. Raport rezumat al evaluării prognostice gradate: un instrument precis și ușor de diagnosticare pentru a estima supraviețuirea pacienților cu metastaze cerebrale. JCO . 2012;30(4):419-425.
- Guirguis LM, Yang JC, White DE și colab. Siguranța și eficacitatea terapiei cu doze mari de interleukină-2 la pacienții cu metastaze cerebrale. J Imunalt . 2002;25(1): 82-87.
- Schadendorf D, Ugurel S, Schuler-Thurner B, et al. Dacarbazina (DTIC) versus vaccinarea cu celule dendritice autologe pulsate cu peptide (DC) in tratamentul de prima linie al pacientilor cu melanom metastatic: un studiu randomizat de faza III al grupului de studiu DC al DeCOG. Ann Oncol . 2006;17(4):563-570.
- Margolin K, Ernsto MS, Hamid O, et al. Ipilimumab la pacienții cu melanom și metastaze cerebrale: un studiu deschis, de fază 2. Lancet Oncol . 2012;13(5):459-465.
- Harris MG, Hulsenberg P, Ling C și colab. Privilegiul imun al SNC nu este consecința prelevării limitate de antigen. Rep științific . 2014;4(4422): 1-10.
- Long GV, Trefzer U, Davies MA, et al. Dabrafenib la pacienții cu melanom cu mutant BRAF Val600Glu sau Val600Lys metastatic la creier (BREAK-MB): un studiu multicentric, deschis, de fază 2. Lancet Oncol . 2012;13(11):1087-1095.
- Antony G și Dudek A. Interleukin 2 în terapia cancerului. Curr Med Chem . 2010;17(29): 3297—3302.
- Chu M, Fesler M, Armbrecht E, et al. Terapia cu doze mari de interleukină-2 (HDIL-2) ar trebui luată în considerare pentru tratamentul pacienților cu metastaze cerebrale melanom. Chemother Res Pract . 2013;2013:726925.
- Dutcher JP, Schwartzentruber DJ, Kaufman HL și colab. Interleukin-2 în doză mare (Aldesleukin) – consensul experților privind cele mai bune practici de management-2014. J Imuno Cancer . 2014;2(26): 1-23.
- Atkins MB, Lotze MT, Dutcher JP și colab. Terapia cu interleukină-2 în doză mare pentru pacienții cu melanom metastatic: analiza a 270 de pacienți tratați între 1985 și 1993. JCO . 1999; 17(7): 2105-2116.
- Barker CF, Billingham RE. Locuri privilegiate din punct de vedere imunologic. Adv Immunol . 1977; 25: 1-54.
- Powell S și Dudek A. Rezultatul unic al terapiei cu interleukină-2 în doză mare (HD IL-2) pentru melanomul metastatic și analiza răspunsului favorabil în metastazele cerebrale. Anticancer Res . 2009; 29(10):4189-4193.
- McDermott DF, Regan MM, Clark JI, et al. Studiu randomizat de fază III de interleukină-2 în doză mare versus interleukina-2 subcutanată și interferon la pacienții cu carcinom cu celule renale metastatic. JCO . 2005;23(1):133-141.
- Wong MK, Kaufman HL, Daniels GA și colab. Implementarea unui registru național de interleukine-2: o oportunitate de a îmbunătăți rezultatele cancerului. JITC . 2014:2:20.
- Bhatia S, Tykodi SS și Thompson JA. Tratamentul melanomului metastatic: o prezentare generală. Oncologie (Williston Park) . 2009;23(6):488-496.
- Parkinson DR, Abrams JS, Wiernik PH și colab. Terapia cu interleukină-2 la pacienții cu melanom malign metastatic: un studiu de fază II. JCO . 1990;8(10):1650-1656.
- Howard JH, Thompson JF, Mozzillo N, et al. Metastatectomie pentru melanom metastatic la distanță: analiza datelor din primul studiu multicentric de limfadenectomie selectivă (MSLT-I). Ann Surg Onc . 2012;19(8):2547-2555.
- Roth JA, Silverstein MJ, Morton DL. Potențialul metastatic al metastazelor. Chirurgie . 1976;79:669—673.
- Clark JM, Kelley B, Bines SD, Batus M, Titze J, Kaufman HL Rezultate clinice și profilul de toxicitate al tratamentului cu doze mari de interleukin-2 (IL-2) la pacienții vârstnici cu melanom metastatic și carcinom cu celule renale. Oncologie . 2013;84(2):123-126.
- Ahmed KA, Stallworth DG, Kim Y, et al. Rezultatele clinice ale metastazelor cerebrale ale melanomului tratate cu radiații stereotactice și terapie anti-PD-1. Ann Oncol . 2016;27(3):434-441.