Pan Pantziarka 1 , 2 , Gauthier Bouche 1 , Lydie Meheus 1 , Vidula Sukhatme 3 și Vikas P Sukhatme 3 , 4
1 Fondul Anticancer, Bruxelles, 1853 Strombeek-Bever, Belgia
2 The George Pantziarka TP53 Trust, Londra KT1 2JP, Marea Britanie
3 GlobalCures, Inc; Newton MA 02459, SUA
4 Beth Israel Deaconess Medical Center și Harvard Medical School, Boston, MA 02215, SUA
Corespondență cu: Pan Pantziarka. E-mail: pan.pantziarka@anticancerfund.org
Abstract
Cimetidina, primul H2antagonist al receptorilor în utilizare clinică pe scară largă, are proprietăți anticanceroase care au fost elucidate într-o gamă largă de studii preclinice și clinice pentru un număr de tipuri diferite de cancer. Aceste date sunt rezumate și discutate în legătură cu o serie de mecanisme distincte de acțiune. Pe baza dovezilor prezentate, se propune ca cimetidina să facă sinergie cu o serie de alte medicamente, inclusiv chimioterapeutice existente și că este justificată o explorare suplimentară a potențialului cimetidinei ca terapie anticanceroasă. În plus, există dovezi convingătoare că administrarea de cimetidină în timpul perioadei perioperatorii poate oferi un beneficiu de supraviețuire în unele tipuri de cancer. O serie de combinații posibile cu alte medicamente sunt discutate în materialul suplimentar care însoțește această lucrare.
Cuvinte cheie: reutilizarea medicamentelor, cimetidină, imunostimulant, proiect ReDO
Copyright: © autori; licențiat ecancermedicalscience. Acesta este un articol cu acces deschis distribuit în conformitate cu termenii licenței de atribuire Creative Commons ( http://creativecommons.org/licenses/by/3.0 ), care permite utilizarea, distribuirea și reproducerea fără restricții pe orice mediu, cu condiția ca lucrarea originală să fie citat corect.
Utilizare curentă
Introducere
Cimetidina (CIM) este un antagonist al receptorului histaminic H2 ( H2RA ) , din aceeași clasă cu ranitidina, famotidina și nizatidina. Prin blocarea acțiunii histaminei asupra celulelor parietale gastrice, H 2 RA sunt capabili să reducă producția de acid gastric și, într-adevăr, CIM, primul medicament din această clasă, a fost dezvoltat ca tratament pentru dispepsie. Pe lângă dispepsie, este utilizat și clinic pentru tratamentul ulcerului peptic și pentru boala de reflux gastroesofagian (GERD). Numele comercial original a fost Tagamet (GlaxoSmithKline), dar medicamentul este acum disponibil pe scară largă ca generic. Este disponibil ca medicament fără prescripție medicală în unele țări, inclusiv în SUA.
Dozare
Oral CIM este disponibil sub formă de tablete și sub formă de suspensie lichidă; se poate folosi si intravenos. Tabletele sunt disponibile în mod obișnuit în doze de 200 mg, 400 mg și 800 mg. Pentru tratamentul ulcerului gastric sau duodenal, doza pentru adulți variază între 800 mg și 1600 mg pe zi, fie în doze unice, fie divizate pe parcursul zilei, pe o perioadă de 4-8 săptămâni. Pentru esofagita de reflux, doza este de 400 mg de patru ori pe zi, pe o perioadă de 4-8 săptămâni. CIM este, de asemenea, utilizat pentru terapia de întreținere a ulcerelor gastrice și a sindromului intestinului scurt la o doză zilnică de 400 mg, cu un tratament pe termen lung care se extinde la mai mult de 10 ani în unele cazuri [ 1 ].
Toxicitate
CIM are toxicitate scăzută, cele mai frecvente efecte secundare fiind durerea de cap, amețelile, diareea și erupția cutanată. Reacțiile adverse rare includ ginecomastie, impotență reversibilă (raportată în special la pacienții cărora li se administrează doze foarte mari, de exemplu, în tratamentul sindromului Zollinger-Ellison) și, foarte rar, galactoree. Rareori, CIM a fost, de asemenea, asociată cu leucopenie reversibilă și trombocitopenie, efecte care pot fi deosebit de importante de urmărit la pacienții cu cancer care pot fi supuși chimioterapiei [ 2 ]. CIM este contraindicată în timpul sarcinii. La copiii cu vârsta peste un an, CIM oral poate fi utilizat la o doză de 25-30 mg/kg greutate corporală pe zi, în doze divizate. Pentru copiii cu vârsta sub un an, a fost utilizată o doză de 20 mg/kg greutate corporală pe zi în doze divizate [ 3 ].
Farmacocinetica
Biodisponibilitatea CIM este de 60-75%, cu un timp de înjumătățire prin eliminare de aproximativ 2-3 ore. Eliminarea se face în principal pe cale renală, cu excreția medicamentului nemodificat între 60% și 40% în funcție de doză și modalitate de administrare [ 4 ]. Concentrațiile plasmatice ajung la aproximativ o oră dacă sunt luate fără alimente sau după 2 ore cu alimente. Când este luat fără alimente, există o a doua creștere a concentrației plasmatice după aproximativ 3 ore. Concentrația plasmatică maximă este abia afectată de alimente, cu valori de 1,18 µg/ml și, respectiv, 1,09 µg/ml, după o doză orală de 200 mg [ 5 ]. Concentrațiile plasmatice în timpul tratamentului continuu cu 1,0 g/zi au fost peste 1,0 µg/ml timp de 9 din 24 de ore [ 4 ].
CIM este un inhibitor al citocromului P450, prin mai multe enzime (inclusiv CYP1A2, CYP2D6 și CYP3A, CYP3A3/A4, CYP2C9 și CYP2C18), care pot avea un impact semnificativ asupra metabolismului unei game largi de medicamente [ 6 , 7 ] . În ceea ce privește chimioterapia, există dovezi, de exemplu, că utilizarea concomitentă a CIM și a epirubicinei poate crește semnificativ aria de sub curbă (ASC) atât a compusului părinte, cât și a principalilor metaboliți la pacienții cu cancer de sân [ 8 ]]. Deși acest lucru sugerează prudență în utilizarea clinică a CIM pentru pacienții cu cancer, există, de asemenea, un potențial pentru beneficii terapeutice dacă acest efect este utilizat în mod deliberat pentru a crește nivelul plasmatic sau a întârzia eliminarea medicamentelor utilizate în scopuri anticanceroase, cum ar fi benzimidazolul anti-cancer. -mebendazol helmintic [ 9 ].
Alte interacțiuni relevante
CIM a fost investigat ca agent pentru reducerea efectelor secundare ale unor tratamente curente. Exemplele includ utilizarea CIM orală (800 mg pe zi) pentru a reduce efectele secundare radioterapia ganglionilor limfatici para-aortici în tratamentul cancerului de col uterin [ 10 ] și în prevenirea flebitei induse de vinorelbină folosind CIM intravenos [ 11 ]. Nefrotoxicitatea este un efect secundar grav al cisplatinei, un efect advers mediat de absorbția reglementată de transportorul cationic organic 2 (OCT2) a medicamentului în tubii proximali. CIM este un inhibitor puternic al OCT2 și in vitroinvestigațiile au arătat că nu a modificat absorbția sau citotoxicitatea cisplatinei într-o linie celulară de cancer ovarian (IGROV-1) care exprimă niveluri ridicate de OCT2. Testele ulterioare pe un model de șoarece nu au arătat nicio diminuare a efectului antitumoral al cisplatinei. La pacienții cu cancer de cap și gât, CIM concomitent (800 mg de două ori pe zi) nu a modificat expunerea la cisplatină nelegată, o măsură indirectă a activității antitumorale [ 12 ].
Dovezi preclinice în cancer – in vitro și in vivo
Interesul timpuriu pentru potențiala acțiune anti-cancer a CIM a fost trezit de investigațiile privind relația dintre nivelurile de histamină și cancer, în special prin constatarea că nivelurile de histamină au fost crescute în țesuturile îndepărtate non-canceroase la șoarecii purtători de tumori [ 13 , 14 ] și a scăzut în plasmă, rezultat confirmat la om [ 15 ]. O investigație timpurie a sugerat că un agonist al receptorului H 2 de histamină a stimulat proliferarea celulară în carcinomul colonic indus de dimetilhidrazină la șobolani, un efect inversat de CIM și un alt H 2 RA (metiamidă) și că un antagonist al receptorului H 1 nu a avut niciun efect [ 16 ].]. Rezultatele inițiale au sugerat, de asemenea, că tratamentul cu metiamidă ar putea încetini creșterea tumorii și crește supraviețuirea la șoarecii purtători de sarcom [ 17 ].
Rezultatele ulterioare in vivo au fost, de asemenea, obținute cu CIM într-un număr de modele de șobolan și șoarece de către diferite grupuri de cercetare, cu atenție concentrată în special asupra mecanismelor imunomodulatoare [ 18 – 20 ]. Alte rezultate timpurii in vivo au indicat că CIM ar putea spori efectul citotoxic al ciclofosfamidei la șoarecii masculi DBA2 injectați cu celule de leucemie P-388, crescând semnificativ timpul de supraviețuire [ 21 ]. Cu toate acestea, au existat probleme cu replicarea studiului și au fost raportate de către Hannant și colab . că rezultatele in vivo de la alte grupuri nu au putut fi reproduse [ 22 ].]. În mod similar, potențarea efectului citotoxic al ciclofosfamidei nu a putut fi replicată cu un alt model de șoarece, deși a fost raportată o potențare a efectului antitumoral al razoxanului [ 23 ].
O posibilă explicație pentru aceste rezultate mixte a fost sugerată de rezultatele la șoarecii DBA2 imunocompetenți și imunodeprimați, care au arătat că CIM a inversat creșterea accelerată a tumorilor implantate la șoarecii imunodeprimați despre care se știe că au niveluri mai mari de activitate a celulelor supresoare, dar nu a avut niciun efect asupra șoarecilor normali ( deși într-unul din cele trei experimente, tratamentul cu CIM a crescut creșterea tumorii la șoarecii normali, un rezultat posibil din cauza creșterii tumorii lente atipic în acest experiment) [ 24 ].
Efectul CIM, adesea în combinație cu alți agenți, în special cu imunomodulatori, cum ar fi interferonul sau IL2, a continuat să fie explorat în numeroase studii in vivo într-o serie de tipuri de cancer, inclusiv melanomul [ 25 ], cancerul ovarian [ 26 ], colorectal. cancer [ 27 ], tumori gastrice [ 28 ], cancer pancreatic [ 29 ], cancer pulmonar [ 30 ] și glioame [ 31] în anii de la începutul anilor 1980. Este dincolo de scopul acestei lucrări de a rezuma pe deplin această gamă largă de studii, dintre care doar câteva au fost menționate aici, mai ales că există o gamă comparabilă de lucrări clinice în curs de desfășurare și care este rezumată în secțiunea următoare. Cu toate acestea, trebuie remarcat faptul că dovezile clinice sunt de interes primar din punctul de vedere al reutilizarii medicamentului [ 32 ].
Date umane în cancer
Una dintre primele referiri la un efect anticancer al CIM provine dintr-un raport de două cazuri publicat în Lancet în 1979 [ 33 ]. În ambele cazuri, pacienții cu boală metastatică au prezentat o oarecare regresie tumorală în urma tratamentului cu CIM. Acest lucru, și explozia ulterioară de rezultate pe animale care s-au concentrat în primul rând pe rolul imunomodulator presupus al CIM, au inițiat multe studii clinice în utilizarea CIM în oncologie. Un studiu complet depășește scopul acestei lucrări, dar principalele rezultate sunt rezumate mai jos, enumerate pentru acele tipuri de cancer pentru care există cel mai înalt nivel de dovezi clinice.
Cancer colorectal
Pe baza rezultatelor anterioare in vitro și in vivo [ 27 ], Adams și colegii au investigat utilizarea CIM perioperatorie la pacienții supuși rezecției chirurgicale a cancerului colorectal. Pacienții de control au prezentat scăderi semnificative ale proliferării limfocitelor și ale imunității mediate celular. În schimb, pacienții tratați cu CIM oral la o doză de 400 mg de două ori pe zi timp de minim 5 zile preoperatorii, apoi intravenos timp de 2 zile postoperatorii, nu au prezentat scăderi semnificative nici ale proliferării limfocitelor, nici ale imunității mediate celular, indicând faptul că CIM a ajutat la reducerea imunosupresiei postoperatorii după rezecție [ 34]. Au existat unele indicii că această diferență ar putea oferi un anumit beneficiu clinic într-o urmărire care a analizat supraviețuirea la 3 ani în două rapoarte ulterioare, care au arătat că, cu o urmărire mediană la 30 de luni, supraviețuirea calculată la 3 ani a fost de 93. % pentru pacienții tratați cu CIM și 59% pentru controale [ 35 , 36 ].
Într-un studiu randomizat, în orb, Svendsen și colab . au tratat 192 de pacienți cu CIM oral, la o doză de 400 mg de două ori pe zi, după o intervenție chirurgicală (rezecție sau exploratorie) pentru cancer de colon (123 de pacienți) sau rectal (69 de pacienți) [ 37]. Tratamentul CIM a început în primele 3 săptămâni după intervenția chirurgicală și a continuat timp de 2 ani. Obiectivul principal a fost mortalitatea specifică cancerului. La pacienții tratați cu intenție curativă (148 de pacienți), nu a existat nicio diferență în acest punct final între brațele de tratament și cele de control. Cu toate acestea, la stratificare, pacienții tratați curativ cu boala Dukes C au avut tendința spre o mortalitate mai mică specifică cancerului, deși aceasta nu a atins o semnificație statistică (reducere de 29%, interval de încredere 90% 2-57%, p = 0,11 test de rang logaritmic) . Nu au existat diferențe între grupuri la pacienții tratați necurativ.
Într-un alt studiu dublu-orb al CIM preoperatorie din Australia, 112 pacienți cu cancer colorectal au fost randomizați la brațe cu doză mică (400 mg de două ori pe zi), cu doză mare (800 mg de două ori pe zi) sau cu placebo [ 38 ]. Tratamentul a fost administrat timp de cinci zile înainte de excizia chirurgicală. Analiza de supraviețuire Kaplan-Meier a arătat că nu au existat diferențe semnificative între grupurile de tratament, deși a existat o tendință către avantajul de supraviețuire în grupul CIM cu doze mari (800 mg) (p = 0,20, testul log-rank). Cu toate acestea, stratificarea prin eroare de replicare (RER) pozitivă sau negativă a tumorilor a arătat o diferență semnificativă statistic între grupul CIM cu doză mare și grupul placebo (p = 0,04, test log-rank) pentru pacienții cu tumori RER negative.
Un studiu multicentric, randomizat, neorb, din Japonia, a raportat supraviețuirea pe termen lung a pacienților cu cancer colorectal tratați postoperator cu CIM oral, la o doză de 800 mg pe zi [ 39 ].]. Au fost înrolați un total de 72 de pacienți cu cancer colorectal și o tumoare primară de T2 sau T3, după excluderea pacienților care au fost tratați anterior cu chimioterapie, radioterapie sau imunoterapie sau care au avut cancere multiple sau complicații severe. Dintre acești 72 de pacienți, doi nu au suferit rezecție curativă, trei nu au primit administrare adecvată a medicamentului și trei al căror stadiu de boală a fost considerat nepotrivit pentru studiu au fost considerați în continuare neeligibili și au fost excluși din analiză. Restul de 64 de pacienți au fost alocați aleatoriu și nu s-au pierdut niciunul în urma urmăririi. Toți pacienții au fost supuși rezecției curative și apoi au primit 200 mg pe zi de 5-U oral timp de un an. Grupul de tratament format din 34 de pacienți a primit suplimentar 800 mg pe zi de CIM pentru perioada de tratament de 1 an. În ambele grupuri, tratamentul a început la 2 săptămâni după operație. Urmărirea medie a fost de 10,7 ani și a arătat că rata de supraviețuire la 10 ani a grupului de tratament a fost de 84,6%, în timp ce cea a unui grup de control a fost de 49,8% (p < 0,0001).
Un studiu de CIM orală în perioada perioperatorie la 49 de pacienți care sufereau de tumori gastrointestinale a investigat efectul asupra răspunsului imun, inclusiv 19 pacienți care sufereau de cancer colorectal [ 40 ].]. Pacienții au fost randomizați la CIM perioperator (24 de pacienți) sau de control (25 de pacienți), cu un număr egal de pacienți cu cancer colorectal (19) în fiecare braț. Pacienții din grupul de tratament au primit 400 mg de CIM oral de trei ori pe zi timp de 7 zile înainte și până în ziua intervenției chirurgicale, iar apoi CIM intravenos la 600 mg de două ori pe zi în timpul și după intervenția chirurgicală timp de 10 zile. Brațul de control a primit standard de îngrijire fără CIM. Punctele finale primare au fost măsurarea stării imunitare, inclusiv limfocitele din sângele periferic, celulele ucigașe naturale (NK) și limfocitele infiltrante tumorale (TIL). Nu au fost evaluate rezultate clinice. În comparație cu hemoleucograma de la indivizi sănătoși, atât brațele de tratament, cât și cele de control au arătat o scădere a proporției de celule T totale, celule T helper și celule NK. Aceste modificări au fost inversate la pacienții din brațul CIM, care au prezentat un număr semnificativ mai mare în a 10-a zi postoperatorie decât martorii. De asemenea, semnificativă a fost diferența dintre numărul de pacienți care au prezentat creșteri ale răspunsului TIL: 68% (17/25) dintre pacienții din grupul de tratament au avut răspunsuri TIL semnificative și doar 25% (6/24) dintre cazuri au avut TIL perceptibil. răspunsuri (p < 0,01).
O revizuire Cochrane din 2012 a H 2 RA ca tratamente adjuvante pentru cancerul colorectal rezecat a reunit date din șase studii clinice randomizate, dintre care cinci au folosit CIM și unul a folosit ranitidină. Revizuirea a constatat o tendință de îmbunătățire a supraviețuirii atunci când H 2 RA au fost utilizate ca terapie adjuvantă la pacienții care au suferit o intervenție chirurgicală cu intenție curativă pentru cancerul colorectal (HR 0,70; 95% CI 0,48-1,03, P = 0,07). Cu toate acestea, analiza celor cinci studii CIM (cu date cumulate pentru 421 de pacienți) a găsit o îmbunătățire semnificativă statistic a supraviețuirii globale (HR 0,53; 95% CI 0,32 până la 0,87) [ 41 ]. În general, autorii au concluzionat că: cimetidina pare să confere un beneficiu de supraviețuire atunci când este administrată ca adjuvant la rezecția chirurgicală curativă a cancerului colorectal .
Melanomul
Cea mai timpurie dovadă clinică a unui efect al CIM asupra melanomului a fost într-o serie de trei cazuri de melanom malign recurent tratat cu cumarină (la o doză de 100 mg pe zi). CIM orală a fost începută cu o doză de 1000 mg pe zi când acești pacienți nu mai răspundeau la tratamentul cu cumarină. În aceste cazuri a existat o regresie rapidă a leziunilor multiple și o îmbunătățire corespunzătoare și de lungă durată a condiției fizice. Într-un alt caz, boala recurentă a fost tratată cu o doză mai mică de cumarină (25 mg) și CIM (1000 mg), dar boala a progresat rapid, iar pacientul a murit la scurt timp după. Acest pacient nu fusese tratat anterior cu cumarină [ 42 ].
Un model similar a fost înregistrat la o serie de șase pacienți cu melanom, dintre care cinci aveau boală diseminată, tratați cu interferon-alfa leucocitar uman, cu puține dovezi de efect. Adăugarea CIM după o perioadă de 6-8 săptămâni a condus la o schimbare remarcabilă, cu remisii complete observate la doi pacienți, o remisie parțială la unul și stabilizarea bolii la altul [ 43 ]. Aceiași autori au raportat ulterior asupra a 20 de pacienți care au fost, de asemenea, tratați cu interferon-alfa fără răspunsuri obiective; introducerea ulterioară a CIM a condus la șase răspunsuri obiective, inclusiv cinci regresii complete și o regresie parțială extinsă și trei cazuri de stabilizare prelungită a bolii [ 44 ].
La acel moment, tratamentul standard de îngrijire pentru melanomul metastatic era tratamentul cu dacarbazină sau nitrozouree, cu o rată obiectivă de răspuns de aproximativ 15% și supraviețuirea globală mediană de 4 luni [ 45 ].
O serie de șapte studii de fază II, la 191 de pacienți, privind utilizarea interferon-alfa 2a recombinant (rIFN-2a), singur și în combinație cu alți agenți, pentru tratamentul melanomului malign diseminat a fost efectuată de Creagan și colab . Unul dintre aceste studii a inclus CIM oral, la o doză de 1200 mg pe zi (300 mg QID), ca imunostimulant [ 46 ]. Rata de răspuns pentru aceste studii diverse a variat de la 0% la 23%, cu o rată de răspuns agregată de 14% (27 din 191 de pacienți), iar timpul mediu de supraviețuire a fost de 6 luni [ 47 ]. Cele mai bune răspunsuri, la 23%, au fost pentru rIFN-2a în monoterapie sau rIFN-2a cu CIM, sugerând niciun beneficiu suplimentar pentru CIM, deși a existat un nivel mai scăzut de toxicitate în grupul CIM.
Un studiu ulterior de fază II, realizat de un alt grup, a analizat combinația de interferon-alfa 2b, IL-2 și cisplatină în melanomul metastatic la un grup de 87 de pacienți, cu și fără CIM orală. O rată globală de răspuns de 27% a fost atinsă la cei 82 de pacienți evaluați pentru răspuns, cu durata medie a răspunsului de 7 luni și supraviețuirea mediană de 10,1 luni. Nu au existat diferențe semnificative între brațele CIM și non-CIM ale studiului [ 48 ].
Este posibil ca diferența de rezultate dintre studiile anterioare și studiile ulterioare mai dezamăgitoare să fie legată de diferitele formulări de interferon utilizate. Forma de interferon folosită de Flodgren și colab . a fost derivată din leucocite umane (HuIFN-alfa (Le)) [ 43 , 44 ], în timp ce lucrările lui Creagan și colab . [ 47 ] și Schmidt și colab . [ 48 ] au folosit interferon 2 alfa recombinant. Interferonii derivați de la om conțin o gamă mai largă de subtipuri de interferon alfa decât interferonii recombinanți, care sunt în mod normal restricționați la alfa 2a sau 2b, și există unele dovezi anecdotice că interferonii recombinanți ar putea să nu fie la fel de eficienți în stoparea dezvoltării tumorii.49 ]. Se poate presupune că CIM interacționează cu unele subtipuri suplimentare de interferon alfa pentru a potența efectul și pentru a îmbunătăți răspunsul la tratament, așa cum sa arătat în studiile anterioare.
Investigarea CIM ca monoterapie în melanomul metastatic a fost, de asemenea, investigată în două studii mici de fază II, pe grupuri diferite. În primul studiu, 19 pacienți netratați anterior au fost tratați cu CIM oral la 1200 mg (300 mg QID). Răspunsurile obiective au fost observate la trei (19%) pacienți, inclusiv un răspuns complet de lungă durată (16 luni), un răspuns aproape complet (21 de luni) și un răspuns parțial (7 luni). Timpul median total până la progresie a fost de 1,4 luni, iar supraviețuirea globală a fost de 6 luni [ 45]. Un studiu ulterior de monoterapie CIM a implicat 15 pacienți naivi tratați cu CIM în doze mari (600 mg QID), deși trei pacienți au prezentat boala stabilă timp de 2-4 luni. Nu s-au înregistrat răspunsuri obiective, iar timpul mediu de supraviețuire a fost de 5,3 luni, ceea ce sugerează o activitate semnificativă mică ca monoterapie la acest grup de pacienți, deși toxicitatea a fost neglijabilă chiar și la această doză mare [ 50 ].
Gastric
Primele îngrijorări au fost ridicate că tratamentul ulcerului duodenal cu CIM ar putea atenua simptomele carcinomului gastric, mascând astfel progresia bolii [ 51 ], sau că CIM în sine poate fi cancerigen și crește riscul de cancer gastric [ 52 ]. Cu toate acestea, supravegherea pe termen lung după punerea pe piață nu a arătat o astfel de asociere [ 53 ].
Un raport din Danemarca a evaluat supraviețuirea globală a pacienților cu cancer gastric tratați cu CIM oral la 800 mg pe zi (400 mg BID) timp de 2 ani. În acest studiu dublu-orb, 181 de pacienți au fost randomizați pentru CIM sau placebo imediat după intervenția chirurgicală sau după decizia de a nu opera. Supraviețuirea mediană în grupul CIM a fost de 450 de zile și 316 zile în grupul placebo, un rezultat semnificativ statistic (p = 0,02, testul log-rank). Ratele de supraviețuire relativă (CIM/placebo) au fost de 45%/28% la 1 an, 22%/13% la 2 ani, 13%/7% la 3 ani, 9%/3% la 4 ani și 2%/0 % la 5 ani [ 54 ].
Cu toate acestea, un studiu randomizat mai mare, dublu-orb, în Marea Britanie, care a implicat 442 de pacienți, nu a găsit un efect pozitiv al CIM orală [ 55 ]. Pacienții au fost randomizați la CIM cu doze mici (400 mg, BID) sau cu doze mari (800 mg, BID) sau placebo până la progresia tumorii, recidiva sau decesul. Supraviețuirea mediană pentru pacienții care au primit CIM a fost de 13 luni (interval de încredere 95%, 9-16 luni) și 11 luni pentru brațul placebo (interval de încredere 95%, 9-14 luni), rezultat care nu a atins semnificație statistică. În cadrul brațelor CIM, supraviețuirea mediană pentru grupul cu doză mare a fost de 13 luni (IC 95% 7-20 luni) și de 13 luni (IC 95% 8-18 luni) pentru doza mică. Supraviețuirea la 5 ani a fost de 21% pentru cei randomizați la CIM, comparativ cu 18% în brațul placebo, din nou un rezultat care nu a atins semnificație statistică.
Carcinom cu celule renale
Cea mai timpurie dovadă clinică că CIM ar putea avea un anumit efect asupra carcinomului cu celule renale (RCC) a fost dintr-un studiu mic care a analizat combinația de CIM și cumarină la 45 de pacienți care sufereau de RCC metastatic [ 56 ].]. Pacienții au fost tratați cu cumarină, 100 mg oral pe zi; în ziua 15 de tratament, CIM oral a fost început la o doză de 1200 mg (300 mg QID), iar tratamentul cu ambele medicamente a fost continuat până la progresia bolii. Din 42 de pacienți evaluabili, au existat trei răspunsuri complete (CR) și unsprezece răspunsuri parțiale (PR), dând o rată de răspuns obiectiv de 33,3%. Doisprezece pacienți au prezentat boală stabilă (SD). Durata mediană a grupului PR a fost de 5 luni (în intervalul 4-21 luni), în timp ce durata mediană a grupului SD a fost de 7,3 luni (în intervalul 4-16,5 luni). Nu au fost raportate toxicități cu tratamentul. Analiza subgrupului a arătat că nu au existat răspunsuri obiective la cei 14 pacienți care nu au suferit nefrectomie, în timp ce cele paisprezece răspunsuri obiective au apărut la cei 31 de pacienți care au suferit nefrectomie.
O serie de studii ulterioare nu au putut reproduce acest rezultat încurajator. Un protocol similar a fost utilizat într-un studiu de fază II pe trei centre care a înrolat 31 de pacienți, dintre care majoritatea (84%) au fost nefrectomizați [ 57]. În timp ce studiul original a folosit CIM la 300 mg de patru ori pe zi, acest studiu a folosit o doză de 400 mg de trei ori pe zi, în toate celelalte privințe protocolul a fost același. Din cei 31 de pacienți tratați, doar doi (6,5%) au prezentat un PR de 63 de săptămâni și 73 de săptămâni. Ambii pacienți au prezentat regresia metastazelor pulmonare. Cinci pacienți au prezentat SD (în intervalul 28-45 săptămâni). În mod similar, un alt studiu mic a folosit un protocol identic cu cel inițial pentru a trata 25 de pacienți, dintre care 21 au fost nefrectomizați. Aici nu au fost înregistrate răspunsuri obiective, deși cinci pacienți au prezentat SD mai mult de 3 luni. O posibilă explicație a disparității poate fi explicată prin starea de performanță mai bună și sarcina tumorală mai mică a pacienților din studiul original [ 58 ].
CIM a fost, de asemenea, investigat în combinație cu interferon-alfa limfoblastoid uman (LIFN-a) în RCC. Un total de 37 de pacienți cu CCR avansat au fost tratați între 1982 și 1995 în Japonia, dintre care 21 de pacienți au avut boală metastatică la prezentare și 15 au avut recurență după nefrectomie. LIFN-a a fost administrat intramuscular la 5 milioane de unități (MU) zilnic timp de 5 până la 7 zile pe săptămână timp de cel puțin 8 săptămâni, iar CIM a fost administrat oral la 200 mg QID [ 59]. Tratamentul a dus la o rată obiectivă de răspuns de 41%, cu un CR la șapte pacienți și un PR la opt. În plus, 12 pacienți au prezentat SD. Pacienții cu metastaze pulmonare au prezentat cel mai bun răspuns la terapie. Ratele de supraviețuire la 5 ani pentru pacienții cu și fără răspuns au fost de 74%, 20% și, respectiv, 41%. Din punct de vedere histopatologic, tumorile de grad înalt au avut un răspuns mai bun la terapia combinată decât tumorile de grad scăzut.
Un studiu de fază III ulterior efectuat de același grup a comparat tratamentul cu LIFN-a în monoterapie cu LIFN-a și CIM, cu 36 de pacienți recrutați numai pentru LIFN-a și 35 de pacienți cu LIFN-a și CIM combinate. Analiza intenție de tratare a arătat un CR, patru pacienți cu PR, 16 cu SD și 12 cu boală progresivă (PD) dintre cei 36, cu o rată globală de răspuns de 13,9%. Din cei 35 de pacienți din brațul LIFN-a și CIM, au existat două cazuri de CR, 8 pacienți cu PR, 13 cu SD și 11 cu PD, obținând o rată de răspuns de 28,6% (P = 0,13). Timpul până la progresie a variat de la 9 la 845 zile (mediana 112 zile) în grupul LIFN-a și de la 31 la 1568 zile (mediana 125 zile) în grupul LIFN-a plus CIM (P = 0,87) [ 60]. În timp ce tind spre un răspuns îmbunătățit, autorii au concluzionat că adăugarea de CIM la LIFN-a nu a îmbunătățit semnificativ rata de răspuns în comparație cu LIFN-a singur.
În ciuda acestei concluzii, interesul pentru combinația de interferon și CIM pentru RCC avansat continuă cu adăugarea altor agenți. De exemplu, combinația dintre LIFN-a, CIM, inhibitorul COX-2 meloxicam și antagonistul receptorului angiotensinei II candesartan a fost investigată în studiul de fază II (I-CCA) care a implicat 51 de pacienți, dintre care 37 (73%) au primit nefrectomie anterioară [ 61]. Pacienții au primit 3-6 MU de LIFN-a, 400 mg CIM BID, 10 mg meloxicam pe zi și 4 mg candesartan pe zi. Inițial a fost utilizat inhibitorul enzimei de conversie a angiotensinei (ECA) perindopril erbumină, dar deoarece aceasta a provocat o tuse persistentă la unii pacienți, a fost înlocuit cu candesartan. CR a fost observată la patru pacienți (8%) și PR la șapte (14%), dând o rată globală de răspuns de 22%. Niciunul dintre cei patru pacienți cu CR nu a recidivat în perioada de urmărire de 16-81 de luni. Dintre pacienții rămași, 24 de pacienți (45%) au avut SD timp de cel puțin 6 luni, producând un beneficiu clinic la 67% dintre pacienți, fără toxicități de gradul 3/4 observate. Supraviețuirea mediană fără progresie și supraviețuirea globală au fost de 12 și, respectiv, 30 de luni.
Utilizarea CIM cu doze mari ca agent unic în RCC metastatic a făcut, de asemenea, obiectul unui studiu clinic de fază II care a implicat 42 de pacienți din Statele Unite. Pacienții, dintre care 38 au fost evaluabili, au fost tratați cu 600 mg CIM QID. Doi pacienți au prezentat CR, unul de 26 de luni și unul de 33 de luni, obținând o rată de răspuns obiectiv de 5,3%. Nu au existat cazuri de PR și patru cazuri de SD (durata în intervalul 3-9 luni). Ambii pacienți cu CR au suferit anterior nefrectomie [ 62 ]. La această doză relativ mare, toxicitatea a fost minimă, fiind raportat un caz de leucopenie ușoară.
Alte tipuri de cancer
În plus față de investigațiile clinice în cancerul colorectal și gastric, melanom și RCC, au existat câteva studii clinice în alte tipuri de cancer. O investigație a unei posibile corelații între CIM preoperatorie și măsurile proliferării celulelor tumorale (colorare Ki-67) în cancerul de sân nu a găsit nicio asociere [ 63 ].
În cancerul pancreatic, există un raport de caz publicat recent de activitate a agentului anti-angiogenic TL-118, care include CIM ca unul dintre cele patru medicamente care alcătuiesc agentul combinat [ 64 ]. În acest raport de caz, o femeie de 75 de ani cu cancer pancreatic inoperabil confirmat radiologic a fost tratată cu TL-118 și gemcitabină și a demonstrat o supraviețuire de lungă durată (16 luni) fără progresie. Întreruperea tratamentului s-a corelat cu o creștere a markerului tumoral CA 19-9, iar reluarea tratamentului a redus nivelurile acestui marker.
În cancerul de prostată metastatic, un studiu timpuriu a analizat combinația de CIM și cumarină, folosind același protocol ca cel pentru melanom și RCC [ 65 ]. Deși nu au fost raportate răspunsuri obiective la cei paisprezece pacienți din studiu, trei pacienți au prezentat o reducere semnificativă a durerii din metastazele osoase și scăderea utilizării analgezice care a persistat până la progresia bolii la 3, 5,5 și 9 luni.
Un mic studiu pe 28 de paciente cu carcinom ovarian seros avansat a constatat că chimioterapiile standard pe bază de platină au crescut cu CIM, la o doză de 800 mg/zi, începând cu 2 săptămâni înainte de operație și continuând sincron cu chimioterapia, au arătat îmbunătățiri semnificative statistic ale supraviețuirii globale, comparativ cu chimioterapie pe bază de platină în monoterapie [ 66 ].
Utilizarea CIM orală în tratamentul sarcomului Kaposi la pacienții cu SIDA a fost investigată la opt pacienți cu boală progresivă (BP) [ 67 ]. CIM a fost administrat oral la o doză de 300 mg QID, crescând la 600 mg QID dacă nu a existat niciun răspuns în decurs de o lună. Din cei opt pacienți evaluați pentru răspuns, unul a prezentat o remisie completă de 7 luni, un pacient a avut un răspuns parțial de 8 luni și unul a prezentat un răspuns mixt de regresie inițială urmată de PD. Ceilalți cinci pacienți prezentau toți PD. Niciun pacient nu a raportat toxicitate și mai mulți au raportat îmbunătățiri simptomatice.
Studii clinice
TL-118 este o combinație nouă de medicamente produsă de Tiltan Pharma Ltd, Israel. Conceput ca un agent anti-angiogenic multi-țintit, cele patru medicamente care alcătuiesc combinația sunt: CIM, ciclofosfamidă în doză mică, diclofenac și sulfasalazina. TL-118 este formulat ca o suspensie orală și este conceput pentru a fi luat de către pacienți acasă, mai degrabă decât administrat într-un cadru clinic. În prezent, există trei studii clinice de fază II cu TL-118:
NCT01509911 este un studiu internațional multicentric în cancerul pancreatic metastatic pentru pacienții care încep tratamentul cu gemcitabină. Rezultatul principal este rata de control al bolii după 16 săptămâni de tratament.
NCT01659502 este un studiu cu un singur centru în cancerul pancreatic. Rezultatul primar este o măsurare a beneficiului clinic (un scor compus bazat pe durere, starea de performanță și greutatea) într-un interval de timp de 2 ani.
NCT00684970 este un studiu multicentric, într-o singură țară, desemnat ca un studiu de fază IIB pentru cancerul de prostată metastatic rezistent la castrare. Obiectivul principal este supraviețuirea fără progresie de la 24 de săptămâni după începerea tratamentului până la 3 ani. Punctele finale secundare includ supraviețuirea globală, timpul până la progresia antigenului specific prostatic (PSA), răspunsul PSA și răspunsul la durere la pacienții evaluabili.
Un studiu de fază II randomizat, dublu-orb, în Australia și Noua Zeelandă (ACTRN12609000769280) investighează utilizarea perioperatorie a CIM la pacienții cu cancer colorectal tratați cu rezecție curativă. Doza este de 800 mg comprimate de două ori pe zi timp de 5 săptămâni, începând cu o săptămână înainte de operație. Rezultatul primar este supraviețuirea fără boală de 2 ani, cu analiză suplimentară de subgrup a pacienților cu colorare tumorală pozitivă pentru antigenele sialil Lewis. Obiectivele secundare includ supraviețuirea pe termen lung fără boală, supraviețuirea globală și durata creșterii postoperatorii a citokinelor inflamatorii, evaluată ca timpul în care concentrațiile plasmatice ale fiecărei citokine (TNF, IL-1B, IL-6, IL-8) sunt crescute. deasupra liniei de bază pre-tratament. Recrutarea în studiu este completă, iar 45% din cohortă au cancer rectal [ 68 ].
Mecanism de acțiune
S-a demonstrat că acțiunea antitumorală a CIM se datorează a patru mecanisme distincte:
• Acțiune anti-proliferativă asupra celulelor canceroase
• Efecte imunomodulatoare
• Efecte asupra adeziunii celulare
• Acțiune anti-angiogenă
Proliferarea celulelor canceroase
S-a demonstrat, in vitro și in vivo , că mai multe tipuri de tumori exprimă enzima de sinteză a histaminei, L-histidin decarboxilaza (HDC) și că tumorile pot secreta niveluri ridicate de histamină în mod paracrin și/sau autocrin. Histamina este foarte pleiotropă, cu funcții multiple care implică răspunsul imun inflamator, secreția de acid gastric și acțiunea ca neurotransmițător. Aceste acțiuni fiziologice diverse sunt mediate de patru receptori de histamină, dintre care H2 și H4 sunt implicați în proliferarea celulelor canceroase, invazia și angiogeneza [ 69 , 70 ].
Un efect direct asupra proliferării celulelor canceroase a fost demonstrat în două experimente de xenogrefă în care histamina exogenă a crescut creșterea tumorii în liniile de celule colorectale umane C170 și LIM2412 implantate la șoareci Balb/c nu/nu , un efect care a fost inversat de CIM oral, dar nu de difenhidramina H 1 RA [ 27 ]. Rezultate similare au fost demonstrate în cancerul gastric, histamina aplicată local crescând proliferarea xenogrefelor MKN45G implantate la șoarecii nuzi, efect abrogat de CIM [ 71 ]. In vitroanaliza atât în liniile celulare de cancer colorectal cât și gastric a arătat că creșterea dependentă de doză a proliferării celulare indusă de histamină a fost asociată cu o acumulare de adenozin monofosfat ciclic (cAMP) [ 27 , 71 ].
Cu toate acestea, există, de asemenea, unele dovezi care sugerează că unele efecte anti-proliferative ale CIM pot să nu fie în întregime legate de activitatea generică ca H2RA . O comparație a efectului anti-proliferativ al diferitelor H 2 RA în liniile celulare de cancer gastric a arătat că CIM a inversat semnificativ proliferarea stimulată de histamină într-o manieră dependentă de doză, ranitidina a avut un efect mai mic, iar famotidina nu a arătat niciun efect [ 72 ]. Acest lucru sugerează fie că există ceva specific în legătură cu legarea CIM la receptorul H2 , fie că există efecte suplimentare în afara țintă ale acțiunii CIM. De exemplu, există, de asemenea, unele dovezi că CIM poate provoca apoptoză în linia celulară de cancer colorectal uman Caco-2, independent de acțiunea sa ca H2 .RA [ 73 ]. În mod similar, în timp ce CIM sa sinergizat cu un nou acid fosfo-valproic pentru a inhiba creșterea tumorii pancreatice la modelele de șoarece, un alt H 2 RA, ranitidina, nu a prezentat o astfel de activitate [ 74 ].
Imunomodularea
Histamina are efecte multiple asupra răspunsurilor imune înnăscute și adaptive, mediate de cei patru receptori ai histaminei (H 1 –H 4 ). În legătură cu cancerul, histamina este asociată cu un micromediu tumoral imunosupresor, incluzând o creștere a activității celulelor T reglatoare CD4 CD25 (Treg), o activitate redusă de prezentare a antigenului a celulelor dendritice (DC), o activitate redusă a celulelor NK și o creștere a activității celulelor mieloide derivate. activitatea celulelor supresoare (MDSC) [ 75 – 77 ].
În particular, legarea histaminei la receptorul H2 este asociată cu suprimarea IL- 12 și stimularea secreției de IL-10 și este implicată cu o schimbare a echilibrului Th1/Th2 către dominanța Th2 a răspunsului imun. Acest efect a fost inversat de CIM în PBMC uman [ 78 ]. În mod similar, într-un model de șoarece HDC knock-out, animalele inoculate subcutanat cu linia celulară de cancer de sân murin LM2 au prezentat o creștere mai lentă a tumorii decât la șoarecii de tip sălbatic HDC. Șoarecii knock-out, lipsiți de histamină endogenă, au arătat o predominanță a citokinelor Th1 și un nivel mai scăzut al expresiei Foxp3 (asociat cu CD4 CD25 Tregs) în comparație cu șoarecii purtători de tumori de tip sălbatic [ 79 ].
În plus față de celulele Treg, ceilalți factori cheie ai micromediului tumoral imunosupresor sunt celulele MDSC, implicate în interacțiunea extinsă cu Treg în promovarea disfuncției celulelor T și în denaturarea răspunsului imun către Th2 [ 80 ]. MDSC-urile exprimă receptorii H 1 –H 3 și există dovezi in vitro și in vivo că blocarea H 1 (folosind cetirizina H 1 RA) sau H 2 (folosind CIM), poate inversa acțiunea imunosupresoare a acestor celule [ 77 ] . De exemplu, adăugarea de CIM a redus sarcina tumorală într-un model de șoarece cu melanom B16 [ 77 ] și într-un model de șoarece de tumoră pulmonară 3LL [77]30 ].
De asemenea, sa demonstrat că CIM crește activitatea de prezentare a antigenului in vitro a DC derivate din monocite, la pacienții cu cancer colorectal avansat, comparativ cu martorii [ 81 ]. O creștere a activității NK în comparație cu controalele netratate cu CIM a fost, de asemenea, observată în operația de bypass cardiopulmonar [ 82 ].
În plus, s-a demonstrat că CIM perioperator inversează inhibarea proliferării limfocitelor indusă de histamină și crește numărul de TIL la pacienții cu cancer colorectal și gastric [ 36 , 40 , 76 ]. Creșterea TIL a fost asociată cu semnificația prognostică în aceste studii și este, de asemenea, considerată semnificativă într-o serie de alte tipuri de cancer, inclusiv cancerul de sân, ovarian, creier și cap și gât.
Adeziunea celulară
S-a demonstrat că CIM are un efect inhibitor asupra aderenței celulelor canceroase la celulele endoteliale, independent de activitatea sa H2RA . Folosind un test de aderență celulară monostrat, adeziunea celulelor de cancer colorectal HT-29 la celulele endoteliale ale venei ombilicale umane a fost investigată pentru CIM și alte două H2 RA (famotidină și ranitidină). Acolo unde CIM a inhibat aderența într-o manieră dependentă de doză, celelalte H2 RA nu au avut niciun efect. Într-un model de șoarece nud, CIM a redus în funcție de doză incidența metastazelor hepatice HT-29, suprimând-o complet la cea mai mare doză (200 mg/kg/zi) [ 83 ]. Efectul asupra aderenței celulare a fost mediat de interacțiunea dintre antigenele tumorale sialil Lewis și E-selectina exprimată pe endoteliu.
Investigațiile ulterioare au arătat că există o corelație pozitivă între răspunsul la tratamentul CIM la pacienții cu cancer colorectal și nivelurile ridicate de expresie ale sialil Lewis-X și sialil Lewis-A [ 39 ]. Rata de supraviețuire cumulativă raportată la 10 ani a grupului CIM cu colorare mai mare a sialil Lewis-X în tumori a fost de 95,5%, în timp ce cea a unui grup de control a fost de 35,1% (P = 0,0001).
În plus față de cancerul colorectal, efectul inhibitor asupra aderenței celulare a fost demonstrat pentru alte tipuri de cancer, inclusiv de sân [ 84 ], tumori ale glandelor salivare [ 85 ], cancer gastric [ 86 ] și glioblastom [ 31 ].
Angiogeneza
Mecanismul final de acțiune care a fost investigat în legătură cu acțiunea anticanceroasă a CIM este efectul pe care îl are asupra neoangiogenezei tumorale. Ghosh și colab . au investigat rolul histaminei în producerea factorului de creștere endotelial vascular (VEGF) în țesutul de granulație indus de caragenină la șobolani și au descoperit că aceasta a fost mediată de receptorul H2 și că reglarea VEGF indusă de histamină a fost inversat de CIM [ 87 ]. Un studiu care compară CIM și roxatidina (un alt H 2 RA), a constatat că ambele medicamente au redus puternic implanturile tumorale de colon 38 la șoarecii singenici C57BL/6 șoareci și că această inhibare a fost legată de expresia redusă a VEGF și densitatea micro-vaselor reduse în tumori implantate [ 88]. În plus, există, de asemenea, dovezi că efectul anti-angiogenic al administrării CIM poate fi, de asemenea, legat de o expresie redusă a factorului de creștere endotelial derivat din trombocite (PDECGF), precum și a VEGF, în modelele de șoarece și șobolan de cancer de vezică urinară [ 89 ] .
Din punct de vedere mecanic, s-a sugerat că expresia VEGF este crescută de histamină prin activarea căii ciclooxigenazei-2 (COX-2) în liniile celulare de cancer colorectal, un proces mediat de receptorii H 2 și H 4 [ 90 ]. Acest proces a fost întrerupt de zolantidina H2RA și H4RA JNJ 7777120. În schimb, CIM nu a arătat niciun efect asupra expresiei VEGF într-un model de celule endoteliale in vitro de angiogeneză [ 91 ].
Aprecierea noastră
Pasii urmatori
Abundența dovezilor clinice arată că CIM are efecte terapeutice demonstrabile într-o serie de tipuri de cancer, în special cancere ale tractului gastrointestinal, RCC și melanom (rezumat în Tabelul 1 ). Există, de asemenea, dovezi, atât in vitro , cât și in vivo , că aceste efecte sunt cel mai probabil legate de efectele imunomodulatoare bine documentate. Mai mult, dovezile indică faptul că aceste efecte se pot extinde dincolo de efectul direct asupra receptorului histaminei H2 și că CIM are efecte în afara țintă care nu sunt împărtășite de alte H2 .RA-uri. Prin urmare, putem ipoteza că o parte din variabilitatea răspunsului la CIM raportată în diferite studii clinice poate fi explicată prin gradul de variabilitate a funcției imune la pacienții cu cancer. În comun cu alți agenți imunoterapeutici, acest lucru sugerează că CIM poate fi mai eficient la pacienții cu sarcină tumorală mai mică și funcție imunitară mai mare și în cancerele cu un potențial antigenic mai mare. Într-adevăr, o explicație oferită pentru diferențele de răspuns raportate de diferite studii clinice în RCC a fost starea de performanță mai bună (legată de sarcina tumorală) la pacienții din studiile timpurii, comparativ cu răspunsul mai slab raportat în studiile ulterioare [ 58 ].
Acest lucru sugerează că, în general, CIM nu ar trebui utilizat ca un singur agent într-un cadru adjuvant sau la pacienții cu sarcină tumorală mare sau în tipuri de cancer despre care se știe că nu răspund bine la intervenția imunoterapeutică. Cu toate acestea, cu această condiție, există încă un spațiu considerabil pentru investigarea clinică a CIM ca imunostimulant, cu o posibilă acțiune anti-metastatică, într-o serie de tipuri de cancer.
În special, există o fereastră de oportunitate în utilizarea CIM pentru a aborda problema imunodepresiei postoperatorii. Se știe că rezecția chirurgicală, un pilon al tratamentului cancerului pentru multe forme de boală, provoacă o suprimare imună post-chirurgicală care poate fi asociată cu un risc crescut de recidivă sau răspândire metastatică [ 92 , 93 ]. Există deja dovezi puternice, rezumate într-o revizuire Cochrane, că CIM perioperatorie este asociată cu o imunosupresie redusă și un risc mai scăzut de reapariție a bolii în rezecția curativă a cancerului colorectal [ 41 ].]. Mai mult, riscul crescut de recidivă post-chirurgicală există și în alte forme de cancer, inclusiv în sân, plămân, cap și gât și osteosarcom. În cancerul de sân, de exemplu, utilizarea perioperatorie a medicamentului antiinflamator nesteroidian (AINS) ketorolac este investigată ca agent potențial pentru a îmbunătăți supraviețuirea după mastectomie [ 94 ]. CIM este de beneficiu potențial în aceste alte tipuri de cancer, pe lângă beneficiul stabilit în cancerul colorectal.
Tabelul 1. Rezumatul dovezilor pe tip de cancer.
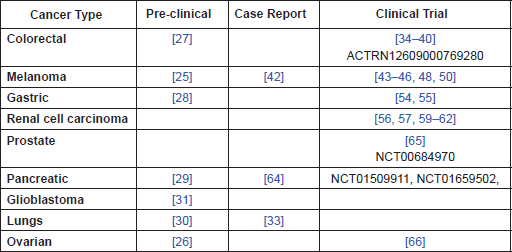
Având în vedere dovezile că CIM perioperatorie reduce imunosupresia post-chirurgicală, se sugerează că este nevoie de studii clinice pentru a stabili dacă poate fi benefică, în ceea ce privește supraviețuirea globală, în următoarele tipuri de cancer:
• Colorectal
• Sânul
• Cancer pulmonar fără celule mici
• Osteosarcom
• Ovarian
• Pancreatic
În aceste studii, poate fi esențial să începeți tratamentul CIM în zilele imediat premergătoare intervenției chirurgicale și să continuați pentru un număr de săptămâni după, într-adevăr, este de remarcat faptul că cele mai impresionante date din studiile clinice arată o supraviețuire dramatică îmbunătățită pentru pacienții colorectali tratați cu orală. CIM (800 mg/zi) și 5-FU oral (200 mg/zi) – grupul tratat cu CIM a avut o supraviețuire pe 10 ani de 84,6% față de 49,8% pentru grupul cu numai 5-FU [ 39 ]. În plus, investigația privind utilizarea combinată perioperatorie a CIM și diclofenac/ketorolac merită atenție.
Există dovezi că un adjuvant imunologic poate fi benefic într-o gamă largă de cancere, inclusiv unele dintre cele în care CIM a demonstrat deja un anumit beneficiu clinic:
• Melanom
• RCC
• Cancer gastric
• Glioblastom
Se sugerează ca CIM să fie investigat ca adjuvant la standardul existent de terapii de îngrijire în aceste boli.
Având în vedere mecanismele de acțiune presupuse primare – cele mai puternice dovezi sunt pentru efectele asupra imunității și adeziunii celulare – există o serie de agenți suplimentari care justifică investigarea pentru sinergia cu CIM, dintre care unii sunt enumerați în materialul suplimentar care însoțește această lucrare.
Protocoale noi
Este instructiv să revizuim studiile clinice în curs de desfășurare ale CIM ca agent anti-cancer, deoarece acestea servesc ca șabloane utile pentru investigațiile viitoare. Studiul australian de CIM perioperator în cancerul colorectal (ACTRN12609000769280) se bazează direct pe o serie de studii anterioare similare, care sunt rezumate efectiv într-o revizuire Cochrane [ 41 ]. Este de sperat că un rezultat pozitiv în acest studiu va concentra din nou atenția asupra potențialului CIM de a afecta pozitiv supraviețuirea globală. De notat, o analiză recentă a rezultatelor pe termen lung a studiului EORTC 22921 a constatat că chimioterapia adjuvantă pe bază de fluorouracil după radioterapia preoperatorie (cu sau fără chimioterapie) nu afectează supraviețuirea fără boală sau globală [ 95 ].], sugerând că aceasta este o indicație în care este nevoie urgentă de progres și unde CIM a demonstrat deja dovezi clinice puternice de efect.
Cu toate acestea, utilizarea CIM pentru a aborda suprimarea imună post-chirurgicală nu este singurul model posibil de utilizare. Celelalte studii clinice în desfășurare combină CIM cu o serie de alți agenți cu costuri reduse pentru a forma noua combinație de medicamente TL-118. În acest model de utilizare, este combinația de mai multe medicamente reutilizate, cu toxicitate scăzută similară și costuri scăzute, care împreună formează opțiuni de tratament eficiente și noi. În acest fel, putem crea protocoale multi-țintite care prezintă riscuri minime pentru pacienți și totuși oferă speranță de eficacitate terapeutică. Un număr dintre aceste protocoale sunt descrise în materialul suplimentar. În mod necesar, astfel de combinații sunt speculative și, deși dovezile pentru agenții individuali pot fi puternice, dovezile pentru aceste combinații sunt adesea mecaniciste sau se bazează numai pe date preclinice.
Concluzie
Dovezile pentru un efect anti-cancer al tratamentului CIM provin din in vitro , in vivo și din cantități considerabile de date umane. Există o serie de mecanisme de acțiune bine descrise, în special de efecte imunomodulatoare multiple, care au fost evaluate în datele din studiile clinice, precum și din in vivo.modele. Ca agent CIM are o farmacocinetică bine stabilită și un profil de toxicitate excelent. Utilizarea sa în studiile clinice împreună cu mai mulți agenți chimioterapeutici nu a evidențiat nicio interacțiune relevantă clinic, cu excepția epirubicinei și a evidențiat un posibil efect protector cu vinorelbină și cisplatină. Prin urmare, este un candidat foarte puternic pentru reutilizare ca tratament oncologic, în special ca tratament perioperator pentru rezecția chirurgicală a tumorilor solide, în combinație cu tratamentele standard existente și alături de alte medicamente reutilizate într-o serie de cancere.
Un număr dintre aceste combinații multi-medicamente au fost subliniate în materialul suplimentar în speranța că clinicienii acționează pe baza acestor date pentru a iniția studiile clinice ca o chestiune de urgență.
Contribuții ale autorului
Autor principal: Pan Pantziarka. Autori colaboratori: Gauthier Bouche, Lydie Meheus, Vidula Sukhatme și Vikas P Sukhatme. Toți autorii au citit și au aprobat manuscrisul final.
Interese concurente
Autorii declară că nu au interese concurente. Toți autorii sunt asociați cu organizații non-profit care au ca scop reutilizarea medicamentelor pentru tratamente oncologice.
Referințe
1. Sabesin SM (1993) Probleme de siguranță legate de tratamentul pe termen lung cu antagonişti ai receptorilor H2 al histaminei Aliment Pharmacol Ther 7 Suppl 2 35–40 PMID: 8103374
2. Chandrasekhara KL, Iyer SK și Macchia RJ (1981) Leucopenie și trombocitopenie cu cimetidină J Natl Med Assoc 73 (2) 92, 98 PMID: 7205981 PMCID: 2552636
3. Joint Formulary Committee (2013) British National Formulary 66th edn (BMJ Group and Pharmaceutical Press)
4. Bodemar G, Norlander B și Walan A (1981) Farmacocinetica cimetidinei după doze unice și în timpul tratamentului continuu Clin Pharmacokinet 6 (4) 306–15 DOI: 10.2165/00003088-198106040-00005 PMID949 :
5. Bodemar G et al (1979) Absorbția cimetidinei înainte și în timpul tratamentului de întreținere cu cimetidină și influența unei mese asupra absorbției cimetidinei–studii la pacienții cu boală de ulcer peptic Br J Clin Pharmacol 7 (1) 23–31 DOI: 10.1111/j.1365-2125.1979.tb00892.x PMID: 760739 PMCID: 1429608
6. Martínez C și colab . (1999) Inhibarea comparativă in vitro și in vivo a citocromului P450 CYP1A2, CYP2D6 și CYP3A de către antagoniștii receptorilor H2 Clin Pharmacol Ther 65 (4) 369–76 DOI: 10,1016-920 (920) 70129-3 PMID: 10223772
7. Michalets EL (1998) Actualizare: interacțiuni medicamentoase cu citocrom P-450 semnificative clinic Farmacoterapia 18 (1) 84–112 PMID: 9469685
8. Murray LS et al (1998) Efectul cimetidinei asupra farmacocineticii epirubicinei la pacienții cu cancer de sân avansat: dovezi preliminare ale unei interacțiuni medicamentoase potențial comune Clin Oncol (R Coll Radiol) 10 (1) 35–8 DOI: 10.1016 /S0936-6555(98)80109-X
9. Bekhti A și Pirotte J (1987) Cimetidina crește concentrațiile serice de mebendazol. Implicații pentru tratamentul chisturilor hidatice hepatice Br J Clin Pharmacol 24 (3) 390–2 DOI: 10.1111/j.1365-2125.1987.tb03186.x PMID: 3663452 PMCID: 1386263
10. Teshima T et al (1990) Terapia cu radiații a ganglionilor limfatici para-aortici în carcinomul colului uterin: utilizarea concomitentă a cimetidinei pentru a reduce efectele secundare acute și subacute ale radiațiilor Clin Ther 12 (1) 71–7 PMID: 2183942
11. Vassilomanolakis M et al (2001) Prevenirea flebitei vinorelbine cu cimetidină. Un studiu de proiectare în două etape Suport Care Cancer 9 (2) 108–11 DOI: 10.1007/s005200000190
12. Sprowl JA et al (2013) Terapia conjunctivă a cisplatinei cu inhibitorul OCT2 cimetidină: influență asupra eficacității antitumorale și a clearance-ului sistemic Clini Pharmacol Ther 94 (5) 585–92 DOI: 10.1038/clpt.2013.145
13. Buttle GA et al (1962) Formarea histaminei și creșterea tumorii Br Journal Cancer 16 131–40 DOI: 10.1038/bjc.1962.13
14. Burtin C și colab . (1981) Creșterea histaminei tisulare la șoareci și șobolani purtători de tumori Br J Cancer 43 (5) 684–8 DOI: 10.1038/bjc.1981.99 PMID: 7248152 PMCID: 2010678
15. Burtin C și colab . (1983) Niveluri scăzute de histamină din sânge la pacienții cu tumori maligne solide Br J Cancer 47 (3) 367–72 DOI: 10.1038/bjc.1983.55 PMID: 6830687 PMCID: 2011313
16. Tutton PJ și Barkla DH (1978) Stimularea proliferării celulare de către receptorii histaminei H2 în adenocarcinomul indus de dimetilhdrazină Cell Biol Int Rep 2 (2) 199–202 DOI: 10.1016/0309-1651(76-679624 :43 )
17. Burtin C și colab . (1982) Scăderea creșterii tumorii prin injecții de histamină sau serotonină la șoarecii purtători de fibrosarcom: influența receptorilor de histamină H1 și H2 Br J Cancer 45 (1) 54–60 DOI: 10.1038/bjc.1982 PMID . : 7059465 PMCID: 2010957
18. Gifford RR, Ferguson RM și Voss BV (1981) Reducerea cu cimetidină a formării tumorii la șoareci Lancet 1 (8221) 638–40 DOI: 10.1016/S0140-6736(81)91555-5 PMID: 6110865
19. Osband ME și colab . (1981) Imunoterapie tumorală de succes cu cimetidină la șoareci Lancet 1 (8221) 636–8 DOI: 10.1016/S0140-6736(81)91554-3 PMID: 6110864
20. Gifford RR, Voss BV și Ferguson RM (1981) Protecția cu cimetidină împotriva provocării letale tumorale la șoareci Chirurgie 90 (2) 344–51 PMID: 6454981
21. Dorr RT și Alberts DS (1982) Cimetidine enhancement of cyclophosphamide antitumour activity Br J cancer 45 (1) 35–43 DOI: 10.1038/bjc.1982.5 PMID: 7059463 PMCID: 2010952
22. Hannant D și colab . (1982) Cimetidina și terapia tumorilor rozătoarelor Br J Cancer 45 (4) 613–4 DOI: 10.1038/bjc.1982.98 PMID: 7073951 PMCID: 2010991
23. Collins M și Hellmann K (1982) Antagonism receptor al histaminei și activitate anti-tumorală Br J Cancer 46 (5) 817–20 DOI: 10.1038/bjc.1982.276 PMID: 6128996 PMCID: 2011159
24. Nordlund JJ și Askenase PW (1983) The effect of histamine, antihistamis, and a masto cell stabilizer on the growth of cloudman melanom cells in DBA/2 mice J Invest Dermatol 81 (1) 28–31 DOI: 10.1111/1523- 1747.ep12538356 PMID: 6863977
25. Szincsák N și colab . (2002) Diferite antihistaminice cu receptorul h2 întârzie în mod diferit creșterea celulelor de melanom uman xenogrefate la șoarecii imunodeficienți Cell Biol Int 26 (9) 833–6 DOI: 10.1016/S1065-69905(04-0909(04- ) 12377215
26. Kikuchi Y și colab . (1985) Efectele cimetidinei asupra creșterii tumorii și funcției imune la șoarecii nuzi purtători de carcinom ovarian uman J Natl Cancer Inst 74 (2) 495–8 PMID: 3871872
27. Adams WJ, Lawson JA și Morris DL (1994) Cimetidina inhibă creșterea in vivo a cancerului de colon uman și inversează creșterea stimulată in vitro și in vivo a histaminei Gut 35 (11) 1632–6 DOI: 10.1136/gut.35.11.1632 PMID : 7828988 PMCID: 1375627
28. Jiang CG și colab . (2010) Cimetidina induce apoptoza în celulele canceroase gastrice in vitro și inhibă creșterea tumorii in vivo Oncol Rep 23 (3) 693–700 PMID: 20127008
29. Sürücü O et al (2004) Inhibarea creșterii tumorii a xenogrefelor de cancer pancreatic uman la șoareci SCID de către cimetidină Inflamm Res 53 Suppl 1 S39–40 PMID: 15054609
30. Zheng Y și colab . (2013) Cimetidina suprimă creșterea tumorii pulmonare la șoareci prin proapoptoza celulelor supresoare derivate din mieloid Mol Immunol 54 (1) 74–83 DOI: 10.1016/j.molimm.2012.10.035
31. Lefranc F et al (2005) Cimetidină combinată și temozolomidă, în comparație cu temozolomidă în monoterapie: creșteri semnificative ale supraviețuirii la șoarecii nuzi purtători de xenogrefe ortotopice multiforme de glioblastom uman U373 J Neurosurg 102 (4) 706–14 DOI: 10.5.10201/5.10. 4.0706 PMID: 15871514
32. Pantziarka P et al (2014) Repurposing Drugs in Oncology (ReDO)-mebendazol ca agent anti-cancer Ecancermedicalscience 8 443 PMID: 25075217 PMCID: 4096024
33. Armitage JO și Sidner RD (1979) Efectul antitumoral al cimetidinei Lancet 1 (8121) 882–3 DOI: 10.1016/S0140-6736(79)91306-0 PMID: 86136
34. Adams WJ și colab . (1994) Cimetidina păstrează funcția imună nespecifică după rezecția colonică pentru cancer Aust NZJ Surg 64 (12) 847–52 DOI: 10.1111/j.1445-2197.1994.tb04562.x PMID: 798.x
35. Adams WJ și Morris DL (1994) Cimetidină de scurtă durată și supraviețuire cu cancer colorectal Lancet 344 (8939-8940) 1768–9 DOI: 10.1016/S0140-6736(94)92907-6 PMID: 8999
36. Adams WJ și Morris DL (1997) Studiu pilot–cimetidina îmbunătățește infiltrarea limfocitară a carcinomului colorectal uman: rezultate ale unui studiu mic de control randomizat Cancer 80 (1) 15–21 DOI: 10.1002/(SICI) 1097-0142(1997) 80:1<15::AID-CNCR3>3.0.CO;2-E PMID: 9210704
37. Svendsen LB et al (1995) Cimetidina ca tratament adjuvant în cancerul colorectal. Un studiu pilot dublu-orb, randomizat Dis Colon Rectum 38 (5) 514–8 DOI: 10.1007/BF02148852 PMID: 7736883
38. Kelly MD și colab . (1999) Studiu randomizat al cimetidinei preoperatorii la pacienții cu carcinom colorectal cu evaluare cantitativă a limfocitelor asociate tumorilor Cancer 85 (8) 1658–63 DOI: 10.1002/(SICI)1097-0142(199895:4) 8<1658::AID CNCR3>3.0.CO;2-Q PMID: 10223557
39. Matsumoto S și colab . (2002) Cimetidina crește supraviețuirea pacienților cu cancer colorectal cu niveluri ridicate de expresie a epitopului sialil Lewis-X și sialil Lewis-A pe celulele tumorale Br J Cancer 86 (2) 161–7 DOI: 10.1038/sj. bjc.6600048 PMID: 11870500 PMCID: 2375187
40. Lin CY și colab . (2004) Administrarea perioperatorie de cimetidină promovează limfocitele din sângele periferic și limfocitele infiltrante tumorale la pacienții cu cancer gastrointestinal: Rezultatele unui studiu clinic controlat randomizat World J Gastroenterol 10 136–42 PMID: 14695785
41. Deva S și Jameson M (2012) Antagoniștii receptorilor de histamină de tip 2 ca tratament adjuvant pentru cancerul colorectal rezecat Cochrane Database Syst Rev 8 (8), p. CD007814 PMID: 22895966
42. Thornes RD, Lynch G și Sheehan MV (1983) Cumarină și cimetidină în melanomul malign. Irish Medical Journal 76 (1) 53 PMID: 6826342
43. Borgström S et al (1982) Human leucocyte interferon and cimetidine for metastatic melanom N Engl J Med 307 (17) 1080–1 DOI: 10.1056/NEJM198210213071716 PMID: 7121522
44. Flodgren P et al (1983) Melanomul malign metastatic: regresia indusă de tratamentul combinat cu interferon [HuIFN-alfa(Le)] și cimetidină Int J Cancer 32 (6) 657–65 DOI: 10.1002/ ijc.2910320603 PMID52165
45. Morton RF și colab . (1987) Studii de fază II ale cimetidinei cu un singur agent și ale combinației N-fosfonacetil-L-aspartat (NSC-224131) plus L-alanozină (NSC-153353) în melanomul malign avansat J Clin Oncol 5 ( 7) 1078–82 PMID: 3598611
46. Creagan ET et al (1987) Trei studii consecutive de fază II ale interferonului alfa-2a recombinant în melanomul malign avansat. Analize actualizate Cancer 59 (3 Suppl) 638–46 DOI: 10.1002/1097-0142(19870201)59:3 <638::AID-CNCR2820591312>3.0.CO;2-0 PMID: 46312 >
47. Creagan ET et al (1990) Melanomul malign diseminat și interferonul recombinant: analiza a șapte investigații consecutive de fază II J Invest Dermatol 95 (6 Suppl) 188S–192S DOI: 10.1111/1523-1747.ep12875512 PMID44 : 6212 PMID42
48. Schmidt H și colab . (2000) Interleukina-2 subcutanată și interferon-alfa plus cisplatină cu și fără cimetidină profilactică la pacienții cu melanom malign metastatic: un studiu de fază II Melanoma Res 10 (1) 66–77 DOI: 10.1097/ 0000839102 -00009 PMID: 10711642
49. Foster GR și Finter NB (1998) Sunt toți interferonii umani de tip I echivalenti? J Viral Hepat 5 (3) 143–52 DOI: 10.1046/j.1365-2893.1998.00103.x PMID: 9658366
50. Mandanas R și colab . (1991) Studiul de fază II al cimetidinei în melanomul metastatic. A Hoosier Oncology Group trial Am J Clin Oncol 14 (5) 397–9 DOI: 10.1097/00000421-199110000-00007 PMID: 1951177
51. Arnot RS (1977) Cimetidina și carcinomul gastric Br Med J 2(6093) p. 1022 DOI: 10.1136/bmj.2.6093.1022-a PMID: 922362 PMCID: 1631768
52. Elder JB, Ganguli PC și Gillespie IE (1979) Cimetidine and gastric cancer Lancet 1 (8124) 1005–6 DOI: 10.1016/S0140-6736(79)92757-0 PMID: 86721
53. Colin-Jones DG et al (1991) Supraveghere post-cimetidină de până la zece ani: incidența carcinomului de stomac și esofag QJ Med 78 (285) 13–9 PMID: 1670060
54. Tønnesen H și colab . (1988) Efectul cimetidinei asupra supraviețuirii după cancerul gastric Lancet 2 (8618) 990–2 DOI: 10.1016/S0140-6736(88)90743-X PMID: 2902494
55. Langman MJS et al (1999) Studiu prospectiv, dublu-orb, controlat cu placebo, randomizat al cimetidinei în cancerul gastric. British Stomach Cancer Group Br J Cancer 81 1356–1362 DOI: 10.1038/sj.bjc.6690457 PMID: 10604733 PMCID: 2362962
56. Marshall ME și colab . (1987) Tratamentul carcinomului renal metastatic cu cumarină (1, 2-benzopironă) și cimetidină: un studiu pilot J Clin Oncol 5 (6) 862–6 PMID: 3585442
57. Herrmann R și colab . (1990) Studiu de fază II cu cumarină și cimetidină în carcinomul cu celule renale avansat Ann Oncol 1 (6) 445–6 PMID: 2083188
58. Venook AP, Davenport Y și Tseng A (1989) Activitatea cumarinei și cimetidinei în carcinomul cu celule renale metastatic J Clin Oncol 7 (3) 402–3 PMID: 2918335
59. Kinouchi T et al (1997) Tratamentul carcinomului renal avansat cu o combinație de interferon-alfa limfoblastoid uman și cimetidină J Urol 157 (5) 1604–7 DOI: 10.1016/S0022-5347(01)64806-7 PMID: 9112486
60. Kinouchi T et al (2006) Studiu prospectiv randomizat de interferon alfa natural versus interferon alfa natural plus cimetidină în carcinomul renal avansat cu metastază pulmonară J Cancer Res Clin Oncol 132 (8) 499–504 DOI: 10.1007/s00432- 006-0095-7 PMID: 16586071
61. Tatokoro M și colab . (2011) Studiu de fază II de tratament combinat cu interferon-α, cimetidină, inhibitor de ciclooxigenază-2 și inhibitor al sistemului renină-angiotensină (terapie I-CCA) pentru carcinomul cu celule renale avansat Cancer Sci 102 (1 ) 137–143 DOI: 10.1111/j.1349-7006.2010.01756.x
62. Inhorn L et al (1992) Cimetidină în doză mare pentru tratamentul carcinomului cu celule renale metastatic. Un studiu Hoosier Oncology Group Am J Clin Oncol 15 (2) 157–9 DOI: 10.1097/00000421-199204000-00012 PMID: 1553905
63. Bowrey PF et al (2000) Histamina, mastocite și proliferarea celulelor tumorale în cancerul de sân: are efect administrarea preoperatorie de cimetidină? Br J Cancer 82 (1) 167–70 DOI: 10.1054/bjoc.1999.0895 PMID: 10638985 PMCID: 2363200
64. Breuer S et al (2013) TL-118-anti-angiogenic treatment in pancreatic cancer: a case report Med Oncol 30 (2) 585 DOI: 10.1007/s12032-013-0585-9 PMID: 23609193
65. Marshall ME, Butler K și Hermansen D (1990) Tratamentul carcinomului de prostată în stadiul D refractar la hormoni cu cumarină (1,2-benzopironă) și cimetidină: un studiu pilot Prostate 17 (2) 95–9 DOI: 10.1002/ pro.2990170203 PMID: 2399194
66. Niwa K et al (2008) Implicații prognostice ale cimetidinei asupra carcinomului ovarian seros avansat legat de expresia ciclooxigenazei-2 Mol Med Rep 1 (1) 119–22 PMID: 21479387
67. Smith TJ și Kaplowitz LG (1991) Studiu pilot al cimetidinei în tratamentul sarcomului Kaposi la pacienții cu sindrom de imunodeficiență dobândită J Nat Cancer Inst 83 (2) 139–41 DOI: 10.1093/jnci/83.2.139-a PMID: 1988689
68. Jameson MB și colab . (2014) Un studiu de fază II randomizat, controlat cu placebo, dublu-orb al cimetidinei perioperatorii în cancerul colorectal precoce J ClinOncol 32 (suppl 3) p. abstr 509
69. Medina VA și Rivera ES (2010) Histamine receptors and cancer pharmacology Br J Pharmacol 161 (4) 755–67 DOI: 10.1111/j.1476-5381.2010.00961.x PMID: 206363928 PMCID: 2929
70. Kennedy L și colab . (2012) Reglarea receptorilor de histamină și histamină a cancerelor gastrointestinale Transl Gastrointest Cancer 1 (3) 215–227 PMID: 24639917 PMCID: 3955103
71. Watson SA și colab . (1993) Efectul histaminei asupra creșterii tumorilor gastrointestinale umane: inversare prin cimetidină Gut 34 (8) 1091–6 DOI: 10.1136/gut.34.8.1091 PMID: 8174960 PMCID: 1374360
72. Hahm KB et al (1996) Comparația efectelor antiproliferative ale antagoniștilor receptorilor 1-histaminic-2, cimetidină, ranitidină și famotidină, în celulele canceroase gastrice Int J Immunopharmacol 18 (6–7) 393–9 DOI: 10.10926/S10926 -0561(96)00044-6 PMID: 9024941
73. Rajendra S et al (2004) Efectul antagoniştilor H2 asupra proliferării şi apoptozei în liniile celulare de cancer colorectal uman Dig Dis Sci 49 (10) 1634–40 DOI: 10.1023/B: DDAS.0000043377.30075.30075 .
74. Mackenzie GG, Huang L, Alston N și Ouyang N și colab . (2013) Direcționarea STAT3 mitocondrială cu noul acid fosfo-valproic (MDC-1112) inhibă creșterea cancerului pancreatic la șoareci. Schneider, G. (ed.) PloS one 8 (5) e61532 DOI: 10.1371/journal.pone.0061532 PMID: 23650499 PMCID: 3641121
75. O’Mahony L, Akdis M și Akdis CA (2011) Reglarea răspunsului imun și a inflamației de către receptorii de histamină și histamină J Allergy Clin Immunol 128 (6) 1153–62 DOI: 10.1016/j.jaci.2011.06.051
76. Li Y și colab . (2005) Efectele administrării perioperatorii de cimetidină asupra limfocitelor din sângele periferic și limfocitelor infiltrante tumorale la pacienții cu cancer gastrointestinal: rezultatele unui studiu clinic controlat randomizat Hepatogastroenterology 52 (62) 504–8 PMID: 15816464
77. Martin RK și colab . (2014) Histamina mastocitară promovează activitatea imunoreglatoare a celulelor supresoare derivate din mieloid J Leukoc Biol 96 (iulie) 1–9 DOI: 10.1189/jlb.5A1213-644R PMID: 246108
78. Elenkov IJ și colab . (1998) Histamina suprimă puternic IL-12 uman și stimulează producția de IL-10 prin receptorii H2 J Immunol 161 (5) 2586–93 PMID: 9725260
79. Hegyesi H et al (2007) Impact of systemic histamine deficiency on the crosstalk between mamary adenocarcinom and T cells J Pharmacol Sci 105 (1) 66–73 DOI: 10.1254/jphs.FP0070636 PMID: 1789558
80. Lindau D și colab . (2013) Rețeaua tumorală imunosupresoare: celule supresoare derivate din mieloid, celule T reglatoare și celule T natural killer Imunologie 138 (2) 105–15 DOI: 10.1111/imm.12036 PMCID: 3575763
81. Kubota T și colab . (2002) Cimetidina modulează capacitatea de prezentare a antigenului a celulelor dendritice de la pacienții cu cancer colorectal Br J Cancer 86 (8) 1257–61 DOI: 10.1038/sj.bjc.6600233 PMID: 119538237 PMCID: 23823
82. Katoh J și colab . (1998) Cimetidina reduce afectarea imunității celulare după operații cardiace cu bypass cardiopulmonar J Thorac Cardiovasc Surg 116 (2) 312–8 DOI: 10.1016/S0022-5223(98)70132-1 PMID : 995:98
83. Kobayashi K și colab . (2000) Cimetidina inhibă aderența celulelor canceroase la celulele endoteliale și previne metastaza prin blocarea expresiei E-selectinei Cancer Res 60 (14) 3978–84 PMID: 10919677
84. Bobek V și colab . (2003) Inhibarea celulelor cancerului de sân de aderență prin medicamente anticoagulante și neoplasmă cu cimetidină 50 (2) 148–51 PMID: 12740651
85. Fukuda M, Kusama K și Sakashita H (2008) Cimetidina inhibă aderența celulelor tumorale a glandei salivare la celulele neuronale și induce apoptoza prin blocarea expresiei NCAM BMC Cancer 8 376 DOI: 10.1186/1471-2407-8-376 PMID : 376 PMID: 376 2635382
86. Liu FR et al (2011) Cimetidina inhibă aderența celulelor canceroase gastrice care exprimă niveluri ridicate de sialil Lewis x în celulele endoteliale vasculare umane prin blocarea expresiei E-selectinei Int J Mol Med 27 (4) 537–44 PMID: 21327325
87. Ghosh AK, Hirasawa N și Ohuchi K (2001) Îmbunătățirea prin histamină a producției de factor de creștere endotelial vascular în țesutul de granulație prin receptorii H(2) Br J Pharmacol 134 (7) 1419–28 DOI: 10.1038/sj.bj372p. PMID: 11724747 PMCID: 1573073
88. Tomita K, Izumi K și Okabe S (2003) Inhibarea angiogenezei indusă de roxatidină și cimetidină suprimă creșterea implanturilor de cancer de colon la șoareci singenici J Pharmacol Sci 93 (3) 321–30 DOI: 10.1254/jphs.93.321 PMID: 25146
89. Chihara Y și colab . (2009) Efectul antitumoral al cimetidinei prin inhibarea factorilor de angiogeneză în carcinogeneza vezicii urinare de șoarece și șobolan indusă de N-butil-N-(4-hidroxibutil) nitrozamină Oncol Rep 22 (1) 23-8 DOI: 10.3892/or_00000401 PMID: 19513500
90. Cianchi F et al (2005) Rolul ciclooxigenazei-2 în mediarea efectelor histaminei asupra proliferării celulare și producției de factor de creștere endotelial vascular în cancerul colorectal Clin Cancer Res 11 (19 Pt 1) 6807–15 DOI: 10.1158/1078 -0432.CCR-05-0675 PMID: 16203768
91. Lu Q și colab . (2013) Histamina promovează sinergic angiogeneza indusă de bFGF prin îmbunătățirea producției de VEGF prin receptorul H1 J Cell Biochem 114 (5) 1009–19 DOI: 10.1002/jcb.24440
92. Shakhar G și Ben-Eliyahu S (2003) Măsuri profilactice potențiale împotriva imunodepresiei postoperatorii: ar putea reduce ratele de recurență la pacienții oncologici? Ann Surg Oncol 10 (8) 972–92 DOI: 10.1245/ASO.2003.02.007 PMID: 14527919
93. Forget P, Simonet O și De Kock M (2013) Chirurgia cancerului induce inflamație, imunosupresie și neoangiogeneză, dar este influențată de analgezice? F1000Res 2 102 PMID: 24358839 PMCID: 3752648
94. Forget P et al (2013) Ketorolac perioperator la pacientele cu cancer de sân cu risc ridicat. Justificare, fezabilitate și metodologia unui studiu prospectiv randomizat controlat cu placebo Ipoteze Med 81 (4) 707–12 DOI: 10.1016/j.mehy.2013.07.033 PMID: 23937996
95. Bosset JF et al (2014) Chimioterapia adjuvantă pe bază de fluorouracil după chimioradioterapie preoperatorie în cancerul rectal: rezultatele pe termen lung ale studiului randomizat EORTC 22921 The Lancet Oncol 15 (2) 184–90 DOI: 10.1016/S1451 )70599-0
Apendice
Introducere
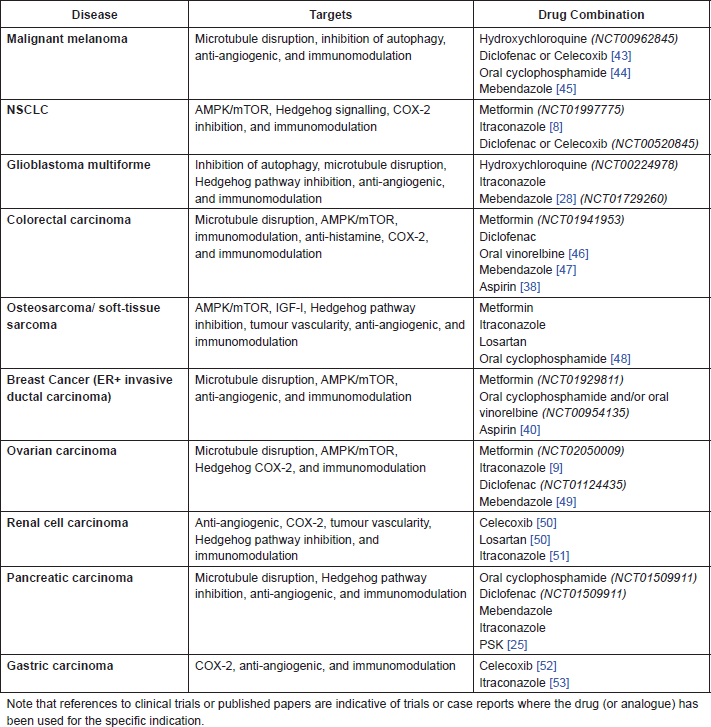
Următoarele medicamente necesită investigații suplimentare în asociere cu cimetidină (CIM), atât în studiile preclinice, cât și potențial în studiile clinice. Aceste combinații, enumerate în Tabelul A1 , au fost selectate pe baza experienței preclinice și clinice existente în fiecare dintre indicații. În unele cazuri, aceste combinații reproduc protocoalele existente testate în prezent în studiile clinice, dar înlocuiesc medicamentele cunoscute și reutilizate cu agenții mai noi și/sau mai toxici care sunt investigați în prezent. Toate aceste combinații propuse sunt de așteptat să prezinte o toxicitate relativ scăzută și să utilizeze agenți cu costuri reduse și disponibili în general.
Agenți cu prioritate mai mare
Agenții enumerați mai jos au un grad ridicat de dovezi clinice de eficacitate și sunt în prezent fie în utilizare clinică în oncologie, fie sunt în prezent investigați în studii clinice. Au fost selectați ca agenți potențiali pentru a fi utilizați în combinație cu CIM. Rețineți că aceste medicamente nu sunt enumerate în ordinea priorității.
• Chimioterapia metronomică — Există un interes clinic crescând pentru utilizarea programelor de dozare metronomică într-o serie de medicamente chimioterapeutice existente, în special ciclofosfamidă, capecitabină, etoposidă, temozolomidă și vinorelbină [ 1 , 2 ]. La dozele continue mici utilizate în chimioterapia metronomică, există puține dovezi ale unui efect citotoxic direct asupra celulelor tumorale, cu dovezi tot mai mari că efectul terapeutic este determinat în primul rând de acțiuni anti-angiogenice și imunomodulatoare [ 3 , 4 ]. Combinarea chimioterapiei metronomice în doze mici cu alți agenți imunoterapeutici este o propunere atractivă care este investigată activ în medii clinice [ 5 , 6 ].]. Având în vedere dovezile puternice că CIM acționează în mai multe moduri imunomodulatoare, există toate motivele să credem că ar face sinergie cu schemele de chimioterapie metronomică existente pentru a inversa suprimarea imună indusă de cancer, pentru a îmbunătăți activitatea limfocitelor T citotoxice și pentru a primi răspunsurile imune în direcția Th1. . Nu există dovezi care să sugereze că adăugarea de CIM la aceste regimuri ar crește nivelurile mai scăzute de toxicitate asociate cu chimioterapia metronomică.
• Itraconazol—Acest medicament antifungic cu spectru larg este sau a fost investigat clinic ca agent anti-cancer într-un număr de studii, inclusiv pentru cancerul de prostată metastatic (NCT00887458), carcinomul bazocelular [ 7 ], plămânul fără celule mici. cancer [ 8 ], cancer ovarian refractar [ 9 ] și cancer mamar triplu negativ [ 10 ]. Mecanismele presupuse de acțiune sunt anti-angiogenice și inhibarea căii de semnalizare Hedgehog [ 11 , 12 ]. Există dovezi preclinice care sugerează că combinația dintre inhibarea căii Hedgehog și țintirea celulelor supresoare derivate din mieloide (MSDC) poate fi o strategie benefică în unele tumori greu de tratat, cum ar fi cancerul pancreatic.13 ]. Se sugerează, prin urmare, ca combinația de itraconazol și CIM să fie investigată în tumorile pancreatice și alte tumori solide. Trebuie remarcat faptul că există unele dovezi în modelele animale ale unei interacțiuni între itraconazol și CIM, astfel încât ASC a CIM a fost crescută cu 25%, efect care poate fi de beneficiu clinic în extinderea efectului terapeutic al acestei combinații de medicamente. 14 ].
• Diclofenac/Ketorolac – Ca și în cazul altor AINS (în special cei cu dovezi ale proprietăților inhibitoare de COX-2), diclofenacul prezintă unele dovezi de activitate anticanceroasă. Există dovezi că diclofenacul sau ketorolacul perioperator sau intraoperator pot fi asociate cu un risc mai scăzut de recidivă a cancerului sau de răspândire metastatică după rezecția chirurgicală a tumorilor [ 15 ]. În plus, există dovezi preclinice ale rolului direct anti-cancer al diclofenacului într-o serie de afecțiuni maligne diferite. De exemplu, există dovezi in vivo în cancerul ovarian [ 16 ], în melanom [ 17 ] și glioblastom [ 18]. Diclofenacul a fost, de asemenea, utilizat în tratamentul tumorilor desmoide la adulți și copii și adolescenți, inclusiv în combinație cu vinblastină [ 19 ]. Mecanismele de acțiune ale diclofenacului includ efecte antiinflamatorii, inhibarea COX-2 și efectele asupra metabolismului celulelor tumorale [ 17 ]. De interes deosebit este efectul imunologic al diclofenacului, despre care sa demonstrat, ex vivo , că inversează puternic imunodepresia post-iradiere [ 20 ]. Se presupune că efectele diclofenacului sau ketorolacului, inclusiv efectele antiinflamatorii și pro-imunitate, ar avea sinergie cu efectele imunoterapeutice ale CIM și că această combinație justifică investigație clinică.
Tabelul A1. Combinații de medicamente propuse cu CIM pentru indicații specifice.
• PSK/PSP—PSK (Polysaccharide K/Krestin) este o polizaharidă legată de proteine izolată din miceliul cultivat al tulpinii CM-101 a ciupercii Coriolus versicolor , care are o lungă istorie de utilizare medicinală în medicina tradițională chineză. PSP (Polysaccharopeptide) este un compus înrudit din tulpina COV-1 de Coriolus versicolor care este, de asemenea, utilizat în scopuri medicinale, deși a existat o investigație mai puțin clinică a PSP în comparație cu PSK [ 21 ].]. PSK a fost utilizat clinic în Japonia de la sfârșitul anilor 1970, în principal cu chimioterapie pentru tratamentul postoperator al cancerelor gastrice, colorectale și pulmonare cu celule mici. Numeroase studii clinice și meta-analize au indicat că există un efect statistic semnificativ asupra supraviețuirii globale și fără boală pentru pacienții tratați cu rezecție curativă urmată de PSK adjuvant în aceste trei tipuri de cancer, iar acestea sunt rezumate eficient de Maehara și colab . [ 22 ] . Au existat mai puține studii clinice care evaluează utilizarea PSP, deși este de remarcat faptul că un studiu mic pe pacienții cu cancer pulmonar fără celule mici a constatat o progresie mai lentă a bolii decât la martorii netratați [ 23 ].]. De asemenea, notabil este un studiu clinic dublu-orb în hemangiosarcomul canin care a constatat că PSP în doze mari a întârziat semnificativ progresia metastazelor și a oferit cei mai lungi timpi de supraviețuire raportați până în prezent în această afecțiune [ 24 ]. Activitatea anti-cancer atât a PSK, cât și a PSP este înțeleasă ca fiind în primul rând datorată diverselor efecte asupra sistemului imunitar, inclusiv inversarea suprimării imune, reglarea în creștere a producției de citokine Th1 și efecte directe asupra celulelor tumorale. Aceste mecanisme de acțiune sunt paralele cu cele ale CIM, sugerând o posibilă sinergie care ar trebui investigată în afecțiunile maligne deosebit de intratabile, cum ar fi cancerul pancreatic [ 25 ] sau sarcoamele de țesut moale.
• Mebendazol—Acest medicament antihelmintic utilizat pe scară largă a demonstrat dovezi preclinice și clinice de activitate împotriva unei game de tipuri de cancer. Este investigat în două studii clinice, cu temozolomidă, în glioblastom și există raportări de cazuri în carcinomul colorectal și adrenocortical [ 26 ]. Mecanismul principal de acțiune ca antiparazitar este inhibarea polimerizării tubulinei în intestinul helminților, iar întreruperea microtubulilor a fost, de asemenea, evaluată în raport cu activitatea sa potențială anticanceroasă, de exemplu într-un model de melanom și glioblastom [ 27 , 28 ] . Există unele dovezi că CIM crește nivelurile plasmatice de vârf ale mebendazolului [ 29], un efect care se poate dovedi util din punct de vedere terapeutic în protocoalele combinate. În special, ambele medicamente prezintă dovezi ale activității anticanceroase în cancerele colorectale și se sugerează că investigațiile clinice sau preclinice pentru boala colorectală sunt justificate.
• Hidroxiclorochina — Medicamentele anti-malarie clorochina și hidroxiclorochina sunt inhibitori cunoscuți ai autofagiei, care sunt investigați în prezent cu o serie de tratamente standard de îngrijire împotriva cancerului [ 30 ]. Rațiunea este că stresurile celulare generate de tratamentele pentru cancer induc un răspuns autofagic din partea celulelor tumorale și că această stare autofagică conferă rezistență la tratament. Inhibarea autofagiei în astfel de cazuri blochează această rezistență și crește sensibilitatea la radio și chimio [ 31 ]. Cu toate acestea, există dovezi interesante că eficiența inhibării autofagiei ca strategie eficientă poate fi compromisă de răspunsurile imune defectuoase [ 32 , 33 ].]. Posibil acest lucru se datorează faptului că inhibarea autofagiei duce la o mai mare moarte celulară imunogenă (ICD) în anumite modalități de tratament, cum ar fi radioterapia, terapia fotodinamică și alte căi de moarte celulară legate de ROS (deși nu neapărat pentru anumiți agenți chimioterapeutici) [ 32 , 34 , 35 ] , dar într-un mediu imunosupresor ICD nu duce la un răspuns imun antitumoral mai mare. Utilizarea CIM pentru a inversa imunosupresia în paralel cu inhibarea autofagiei (cu clorochină, hidroxiclorochină sau alt inhibitor, cum ar fi antibioticul claritromicină [ 36 ]), ar putea fi, prin urmare, o strategie fructuoasă de urmat într-un studiu clinic.
• Aspirina—Există dovezi epidemiologice abundente ale unui efect preventiv de cancer al utilizării pe termen lung a aspirinei, rezumate, de exemplu, de Thun et al [ 37 ], în ultimii ani s-a manifestat, de asemenea, un interes din ce în ce mai mare pentru efectele adjuvante ale tratamentului cu aspirina. 38 – 40 ]. În special, utilizarea aspirinei post-diagnostic s-a dovedit a fi asociată cu o supraviețuire globală îmbunătățită în cancerele colorectal, de sân, de prostată și esofago-gastric [ 40 , 41 ]. Există, de asemenea, unele dovezi că utilizarea aspirinei este asociată cu o supraviețuire îmbunătățită pe termen lung în cancerul pulmonar fără celule mici tratat cu rezecție curativă [ 42 ].]. Se propune, prin urmare, ca aspirina să fie combinată cu CIM pentru protocoale postoperatorii pe termen lung într-o serie de indicații de cancer, inclusiv cancerul colorectal și cel mamar.
Referințe
1. André N, Carré M și Pasquier E (2014) Metronomie: spre chimioterapie personalizată? Nat Rev Clin Oncol 11 (7) 413–31 DOI: 10.1038/nrclinonc.2014.89 PMID: 24913374
2. Lien K et al (2013) Low-dose metronomic chemotherapy: a systematic literature analysis Eur J Cancer 49 (16) 3387–95 DOI: 10.1016/j.ejca.2013.06.038 PMID: 23880474
3. Nars MS și Kaneno R (2013) Efecte imunomodulatoare ale chimioterapiei cu doze mici și perspective ale combinației sale cu imunoterapie Int J cancer 132 (11) 2471–8 DOI: 10.1002/ijc.27801
4. Hahnfeldt P, Folkman J și Hlatky L (2003) Minimizing long-term tumor burden: the logic for metronomic chemotherapeutic dozing and its antiangiogenic basis J Theor Biol 220 (4) 545–54 DOI: 10.1006 / jtbi.20623.32.2023
5. Lasalvia-Prisco E și colab . (2012) Adăugarea unui regim de inducție a antiangiogenezei și imunității antitumorale la chimioterapia standard îmbunătățește supraviețuirea în bolile maligne avansate Med Oncol 29 (5) 3626–33 DOI: 10.1007/s12032-012-1 PMID 0301 : 22810591 PMCID: 3505507
6. Soriano JL et al (2011) Chimioterapia cu ciclofosfamidă și metotrexat metronomic combinată cu vaccinul anti-idiotip 1E10 în cancerul de sân metastatic Int J Breast Cancer 2011 (Mc) ID articol 710292 DOI: 10.4061/2011/71
7. Kim DJ și colab . (2014) Studiu de fază II, deschis, exploratoriu, al itraconazolului oral pentru tratamentul carcinomului bazocelular J Clin Oncol pp. 1–7 DOI: 10.1200/JCO.2013.49.9525
8. Rudin CM și colab . (2013) Studiul de fază 2 al pemetrexedului și itraconazolului ca terapie de linia a doua pentru cancerul pulmonar non-squamos non-small-cell metastatic J Thorac Oncol 8 (5) 619–23 PMID: 23546045 PMCID: 3636564
9. Tsubamoto H și colab . (2014) Impactul chimioterapiei combinate cu itraconazol asupra supraviețuirii pacienților cu cancer ovarian refractar Anticancer Res 34 (5) 2481–7 PMID: 24778064
10. Tsubamoto H, Sonoda T și Inoue K (2014) Impactul itraconazolului asupra supraviețuirii pacienților pretratați intens cu cancer de sân triplu negativ Anticancer Res 34 (7) 3839–44 PMID: 24982411
11. Chong CR și colab . (2007) Inhibarea angiogenezei de către medicamentul antifungic itraconazol ACS Chem Biol 2 (4) 263–70 DOI: 10.1021/cb600362d PMID: 17432820
12. Antonarakis ES et al (2013) Reutilizarea itraconazolului ca tratament pentru cancerul de prostată avansat: un studiu randomizat de fază II necomparativ la bărbați cu cancer de prostată rezistent la castrare metastatic Oncologist 18 (2) 163–73 DOI: 10.1634/theoncologist. 314 PMID: 23340005 PMCID: 3579600
13. Hamada S, Masamune A și Shimosegawa T (2013) Strategii terapeutice noi care vizează interacțiunile tumorale-stromale în cancerul pancreatic Front Physiol 4 331 DOI: 10.3389/fphys.2013.00331 PMID: 24273517 PMCID: 331
14. Karyekar CS et al (2004) Interacțiunea renală între itraconazol și cimetidină J Clin Pharmacol 44 (8) 919–27 DOI: 10.1177/0091270004266783 PMID: 15286096
15. Forget P et al (2014) Utilizarea intraoperatorie a ketorolac sau diclofenac este asociată cu supraviețuirea fără boală îmbunătățită și supraviețuirea globală în chirurgia conservatoare a cancerului de sân Br J Anaesth 1–6 DOI: 10.1093/bja/aet464 PMID: 24464611
16. Zerbini LF et al (2011) Efectul combinatoriu al medicamentelor antiinflamatorii nesteroidiene și al inhibitorilor NF-κB în terapia cancerului ovarian PloS One 6 (9) e24285 DOI: 10.1371/journal.pone.0024285 PMCID: 3171406
17. Gottfried E și colab . (2013) Aspecte noi ale unui medicament vechi – diclofenac vizează MYC și metabolismul glucozei în celulele tumorale PloS One 8 (7) e66987 DOI: 10.1371/journal.pone.0066987 PMID: 23874405 PMCID: 3706586
18. Chirasani SR et al (2013) Diclofenacul inhibă formarea lactatului și contracarează eficient suprimarea imună locală într-un model de gliom murin Int J Cancer 132 (4) 843–53 DOI: 10.1002/ijc.27712
19. Lackner H și colab . (2004) Tratamentul multimodal al copiilor cu tumori desmoide nerezecabile sau recurente: un studiu observațional longitudinal de 11 ani J Pediatr Hematol Oncol 26 (8) 518–22 DOI: 10.1097/01.mph.0000130289.00001302849 . : 15284591
20. Wasserman J și colab . (1989) Immunosupresie la pacienții cu cancer de sân iradiat: efectul in vitro al inhibitorilor de ciclooxigenază Bull NY Acad Med 65 (1) 36–44 PMID: 2513994 PMCID: 1807786
21. Ng TB (1998) O revizuire a cercetării privind polizaharida legată de proteine (polizaharopeptidă, PSP) din ciuperca Coriolus versicolor (Basidiomycetes: Polyporaceae) Gen Pharmacol 30 (1) 1–4 DOI: 10.1016/S0306-3762 )00076-1 PMID: 9457474
22. Maehara Y și colab . (2012) Mecanismul biologic și efectul clinic al polizaharidei K legate de proteine (KRESTIN(®)): revizuirea dezvoltării și perspectivelor viitoare Surg Today 42 (1) 8–28 DOI: 10.1007/s00595-011- 0075-7 PMCID: 3253283
23. Tsang KW et al (2003) Peptida polizaharidă Coriolus versicolor încetinește progresia cancerului pulmonar non-small cell Respir Med 97 (6) 618–24 DOI: 10.1053/rmed.2003.1490 PMID: 1281414
24. Brown DC și Reetz J (2012) Polizaharopeptida cu un singur agent întârzie metastazele și îmbunătățește supraviețuirea în hemangiosarcomul natural Evid Based Complement Alternat Med eCAM DOI: 10.1155/2012/384301 PMCID: 3440946
25. Onishi H et al (2013) Polizaharida legată de proteine scade invazivitatea și proliferarea în cancerul pancreatic prin inhibarea semnalizării ariciului și a căilor HIF-1α sub hipoxie Cancer Lett 335 (2) 289–98 DOI: 10.1016/j.canlet.0202. .041 PMID: 23485726
26. Pantziarka P et al (2014) Repurposing drugs in oncology (ReDO)-mebendazol as an anti-cancer agent Ecancermedicalscience 8 443 PMID: 25075217 PMCID: 4096024
27. Doudican N, Rodriguez A, Osman I și Orlow SJ (2008) Mebendazol induce apoptoza prin inactivarea Bcl-2 în celulele de melanom chimiorezistente Mol Cancer Res 6 (8) 1308–15 DOI: 10.1158/1541-7786-MCR-07 2159 PMID: 18667591
28. Bai R și colab . (2011) Mebendazolul antiparazitar prezintă beneficii de supraviețuire în 2 modele preclinice de glioblastom multiform Neuro Oncol 13 (9) 974–82 DOI: 10.1093/neuonc/nor077 PMID: 21764822 PMCID: 14
29. Bekhti A și Pirotte J (1987) Cimetidina crește concentrațiile serice de mebendazol. Implicații pentru tratamentul chisturilor hidatice hepatice Br J Clin Pharmacol 24 (3) 390–2 DOI: 10.1111/j.1365-2125.1987.tb03186.x PMID: 3663452 PMCID: 1386263
30. Carew JS, Kelly KR și Nawrocki ST (2012) Autophagy as a target for cancer therapy: new developments. Cancer Manag Res 4 357–65 PMID: 23091399 PMCID: 3474143
31. Choi KS (2012) Autophagy and cancer Exp Mol Med 44 (2) 109–20 DOI: 10.3858/emm.2012.44.2.033 PMID: 22257886 PMCID: 3296807
32. Ko A et al (2014) Inhibarea autofagiei radiosensibilizează in vitro, dar reduce radiorăspunsurile in vivo datorită semnalizării imunogene deficitare Cell Death Differ 21 (1) 92–9 DOI: 10.1038/cdd.2013.124
33. Bugaut H și colab . (2013) Bleomicina exercită efect imun antitumoral ambivalent prin declanșarea atât a morții celulelor imunogene, cât și a proliferării celulelor T reglatoare PloS One 8 (6) e65181 DOI: 10.1371/journal.pone.0065181 PMCID: 836037 PMID : 831237
34. Garg AD et al (2013) Autofagia indusă de ROS în celulele canceroase ajută la evitarea determinanților morții celulelor imunogene Autophagy 9 (9) 1292–307 DOI: 10.4161/auto.25399 PMID: 23800749
35. Michaud M et al (2011) Răspunsuri imune anticancer dependente de autofagie induse de agenți chimioterapeutici la șoareci Știință 334 (6062) 1573–7 DOI: 10.1126/science.1208347 PMID: 22174255
36. Moriya S și colab . (2013) Antibioticele macrolide blochează fluxul de autofagie și se sensibilizează la bortezomib prin inducția CHOP mediată de stresul reticulului endoplasmatic în celulele de mielom Int J Oncol 42 (5) 1541–50 DOI: 10.3892/ijo : 2036.12.2036 .
37. Thun MJ, Jacobs EJ și Patrono C (2012) The role of aspirin in cancer prevention Nat Rev Clin Oncol 9 (5) 259–267 DOI: 10.1038/nrclinonc.2011.199 PMID: 22473097
38. Bastiaannet E și colab . (2012) Utilizarea aspirinei postdiagnostic îmbunătățește supraviețuirea pacienților cu cancer de colon Br J Cancer 106 (1532-1827 (Electronic)), 1564–70 DOI: 10.1038/bjc.2012.101 PMID: 223485640 : 223485640
39. Langley RE et al (2011) Aspirina și cancerul: a fost trecută cu vederea aspirina ca terapie adjuvantă? Br J Cancer 105 (8) 1107–13 DOI: 10.1038/bjc.2011.289 PMID: 21847126 PMCID: 3208483
40. Fraser DM et al (2014) Utilizarea aspirinei și supraviețuirea după diagnosticul cancerului de sân: un studiu de cohortă bazat pe populație Br J Cancer 111 (3) 623–7 DOI: 10.1038/bjc.2014.264 PMID: 24945997 PMCID: 96
41. Phillips I et al (2013) Aspirina ca tratament pentru cancer Clin Oncol 25 (6) 333–5 DOI: 10.1016/j.clon.2013.03.001
42. Fontaine E și colab . (2010) Rezecții cu aspirină și non-small cell pulmonar cancer: efect asupra supraviețuirii pe termen lung Eur J Cardiothorac Surg 38 21–26 DOI: 10.1016/j.ejcts.2010.01.015 PMID: 20359903
43. Bhatt RS et al (2010) Un studiu pilot de fază 2 de paclitaxel în doză mică, perfuzie continuă sau „metronomic” și celecoxib oral la pacienții cu melanom metastatic Cancer 116 (7) 1751–6 DOI: 10.1002/cncr.24902 PMID: 20120033 PMCID: 2847062
44. Borne E și colab . (2010) Ciclofosfamidă metronomică orală la vârstnici cu melanom metastatic Invest New Drugs 28 (5) 684–9 DOI: 10.1007/s10637-009-9298-5
45. Doudican NA et al (2013) Reglarea XIAP însoțește inhibarea creșterii mebendazolului în xenogrefele melanomului Medicamente anticancer 24 (2) 181–8 DOI: 10.1097/CAD.0b013e32835a43f1
46. Briasoulis E și colab . (2009) Studiu de dozare a vinorelbinei metronomice orale la pacienții cu cancer refractar avansat Clin Cancer Res 15 (20) 6454–61 DOI: 10.1158/1078-0432.CCR-09-0970 PMID: 87198
47. Nygren P și colab . (2013) Repoziționarea medicamentului antihelmintic mebendazol pentru tratamentul cancerului de colon J Cancer Res Clin Oncol 139 (12) 2133–40 DOI: 10.1007/ s00432-013-1539-5 PMID : 53845358
48. André N et al (2011) Studiu pilot al unui regim pediatric metronomic cu 4 medicamente Oncotarget 2 (12) 960–5 PMID: 22156656 PMCID: 3282100
49. Mukhopadhyay T și colab . (2002) Mebendazolul determină un efect antitumoral puternic asupra liniilor de celule canceroase umane atât in vitro, cât și in vivo Clin Cancer Res 8 (9) 2963–9 PMID: 12231542
50. Tatokoro M și colab . (2011) Studiu de fază II de tratament combinat cu interferon-α, cimetidină, inhibitor de ciclooxigenază-2 și inhibitor al sistemului renină-angiotensină (terapie I-CCA) pentru carcinomul cu celule renale avansat Cancer Sci 102 (1 ) 137–143 DOI: 10.1111/j.1349-7006.2010.01756.x
51. Nacev BA et al (2011) Medicamentul antifungic itraconazolul inhibă glicozilarea receptorului 2 al factorului de creștere endotelial vascular (VEGFR2), traficul și semnalizarea în celulele endoteliale J Biol Chem 286 (51) 44045–56 DOI: 10/11.1. 278754 PMID: 22025615 PMCID: 3243534
52. Han X și colab . (2014) Efectul celecoxib plus chimioterapie standard asupra nivelurilor serice ale factorului de creștere endotelial vascular și ciclooxigenază-2 la pacienții cu cancer gastric Biomed Rep 2 (2) 183–187 PMID: 24649093 PMCID: 3917754
53. Song Z et al (2011) Calea ariciului sonic este esențială pentru menținerea celulelor stem asemănătoare cancerului în cancerul gastric uman PloS One 6 (3) e17687 DOI: 10.1371/journal.pone.0017687 PMID: 21394208 PMCID: 304488710