Yasantha Rajapakse și Glen C Hawkins
Cuvinte cheie medicină hiperbară, implant, proteză, eșec de reconstrucție
Pentru referință Rajapakse Y & Hawkins GC. Terapia cu oxigen hiperbaric în tratamentul complicațiilor plăgii induse de radiații ale cancerului de sân. Practica și cercetarea rănilor 2020; 28(3):133-136.
DOI https://doi.org/10.33235/wpr.28.3.133-136
Abstract
Chirurgia reconstructivă este o procedură foarte comună în timpul tratamentului cancerului de sân. În prezența radioterapiei adjuvante, ratele de eșec sunt foarte mari din cauza vindecării slabe a rănilor.
Prezentăm două studii de caz în care intervenția chirurgicală semnificativă așteptată a fost evitată datorită tratamentului cu oxigenoterapie hiperbară (HBOT), în special în prezența unei proteze.
Introducere
Tratamentul actual al cancerului de sân implică îndepărtarea tumorii fie printr-o mastectomie, fie printr-o intervenție chirurgicală de conservare a sânilor (lumpectomie). În chirurgia de conservare a sânilor, radioterapia este adesea folosită ca tratament adjuvant după intervenția chirurgicală 1 .
O analiză din 2009 a raportat că ratele de complicații după mastectomie au fost de peste două ori mai mari atunci când intervenția chirurgicală a fost urmată de radioterapie 2 . Deteriorarea postoperatorie a plăgii după radioterapie este deosebit de problematică, deoarece apare în prezența procedurilor de reconstrucție, de obicei, cu un implant sau un expansor de țesut. Defalcarea ulterioară a plăgii din cauza leziunilor tisulare prin radiații în aceste situații poate duce la eșec protetic și, prin urmare, reconstructiv, ducând la intervenții chirurgicale ulterioare într-un pat de țesut compromis.
Radioterapia are ca rezultat pierderea progresivă a vaselor mici de sânge în câmpul iradiat (hipovascularitate) conducând la hipoxie și moartea celulelor (hipocelularitate) 3 . Țesutul devine din ce în ce mai fibros și, într-un punct critic, se poate descompune pentru a forma un ulcer spontan sau poate nu se vindeca în urma unei intervenții chirurgicale, cum ar fi reconstrucția cu sau fără proteză.
După radioterapie, vindecarea rănilor s-a dovedit a fi grav afectată din mai multe motive 4 și s-a demonstrat, de asemenea, că crește rata de complicații chirurgicale atât a reconstrucțiilor autologe, cât și a celor bazate pe implant 5,6 . Terapia cu oxigen hiperbaric (HBOT) a fost bine descrisă pentru a trata complicațiile tisulare induse de radiații 7 . Cu toate acestea, în prezent, există puține rapoarte privind eficacitatea acestuia în tratamentul rănilor secundare radioterapiei a sânului, în special în prezența unei proteze. Enomoto și colab. 8descrieți un caz uman de ulcer cutanat refractar care s-a dezvoltat la 26 de ani după o mastectomie inițială urmată de radioterapie. Acest lucru a fost tratat cu succes cu 101 sesiuni de HBOT pe parcursul a 1 an. Snyder şi colab. 9 raportează utilizarea a 20 de ședințe HBOT preoperator și 10 postoperator la cinci pacienți care au avut reduceri mamare bilaterale după tumorectomie unilaterală și radioterapie. Ratele de complicații au fost similare între sânii iradiați și neiradiați.
Raportăm două cazuri de complicații ale plăgii în urma radioterapiei, unul cu o prezentare precoce și unul tardiv, ambele fiind tratate cu succes cu HBOT. Ambii pacienți și-au dat acordul complet în scris pentru publicarea cursului lor clinic și a fotografiilor rănilor lor.
Studii de caz
Cazul 1
O femeie de 40 de ani, fără alte comorbidități medicale, s-a prezentat în decembrie 2018 pentru tratamentul unei plăgi după tumorectomie și radioterapie. Pacienta a fost diagnosticată cu carcinom al sânului exterior superior drept (stadiul IIA T2N0M0) în iunie 2018. A suferit o tumorectomie și apoi, 4 săptămâni mai târziu, a fost efectuată radioterapie cu fascicul extern (50Gy peste 25 de fracții urmată de o doză de rapel de 10Gy peste 10). fracții). Tamoxifen a fost început după terminarea radioterapiei.
La o lună după radioterapie, a apărut o dehiscență a plăgii de 5 mm la marginea de la ora 9 a mamelonului drept. Ea a mai suferit o intervenție chirurgicală în octombrie 2018, iar rana a fost debridată și resuturată. Postoperator, a existat o dehiscență suplimentară și pacientul a fost îndrumat pentru HBOT. La momentul prezentării a existat o rană adâncă de 25 mm x 25 mm x 20 mm (Figura 1) prezentă timp de 2 luni. Nu au existat dovezi clinice de infecție. cu toate tampoanele de rană negative pentru creșterea bacteriilor.
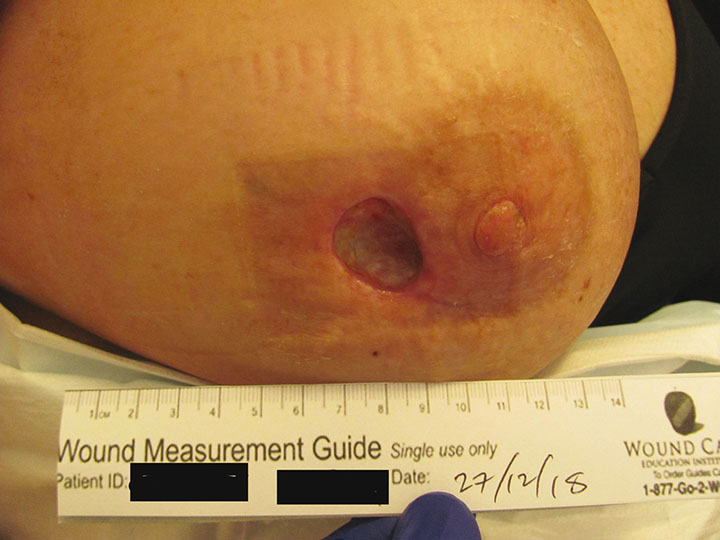
Figura 1. Tratamentul pre-HBOT al sânului drept (adâncimea sondei 20 mm)
A complicat prezentarea a fost faptul că a suferit o mărire cosmetică bilaterală a sânilor cu 10 ani mai devreme cu implanturi rotunde cu gel siliconic de 400cc. A existat un risc semnificativ ca, dacă deteriorarea plăgii s-a înrăutățit, acest lucru ar avea ca rezultat expunerea implantului, necesitând îndepărtarea unilaterală a implantului și un defect cosmetic ulterior.
HBOT a fost prescris cu scopul specific de a-și vindeca rana în timp ce reține implantul. Ea a finalizat 60 de tratamente fără incidente pe parcursul a 3 luni. Fiecare tratament HBOT a fost efectuat la 243 kPa timp de 90 de minute, 5 zile pe săptămână, într-o cameră multiloc Fink SL8. Figura 2 prezintă rana la sfârșitul tratamentului, la 3 luni după prezentarea inițială. La 9 luni de la prezentarea inițială, rana ei continuă să se vindece, nefiind nevoie de îngrijire suplimentară a plăgii. (Figurile 3a și 3b).
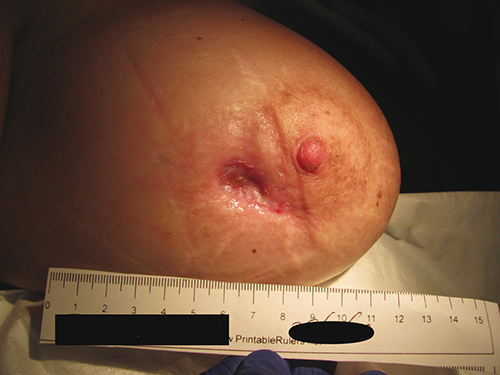
Figura 2. Rană la sfârșitul a 60 de tratamente, la 3 luni după prezentarea inițială
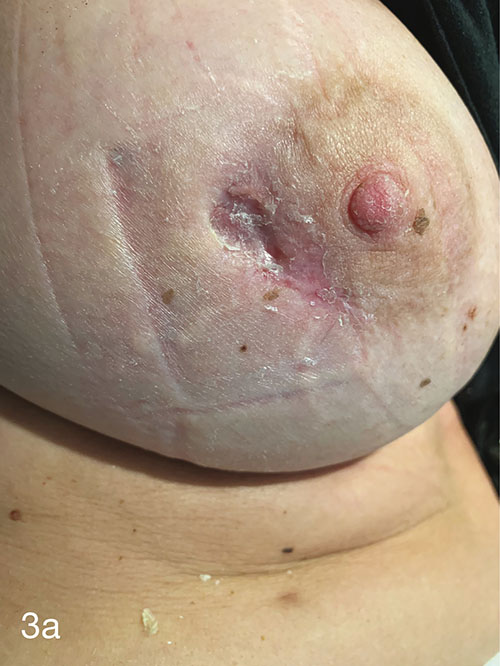
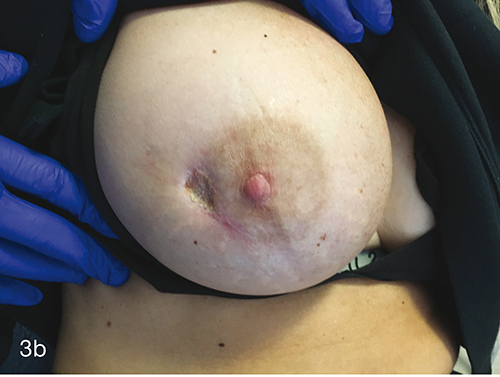
Figurile 3a și 3b. 9 luni de la prezentarea inițială
Cazul 2
O femeie de 76 de ani, fără alte comorbidități medicale, s-a prezentat în martie 2019 cu un ulcer nevindecător al peretelui toracic stâng după o mastectomie cu clearance axilar și chimio-radioterapie pentru un carcinom ductal infiltrant stâng (T3N1M0 stadiul IIIA) în septembrie 2014 Ea a primit 50 Gy la peretele toracic stâng în 25 de fracțiuni și 50 Gy în zona supraclaviculară stângă în 25 de fracțiuni timp de 4 săptămâni.
Nu a avut probleme postoperatorii până în noiembrie 2018, când a dezvoltat un serom care necesita aspirație. O biopsie tisulară la momentul respectiv nu a evidențiat nicio recidivă a tumorii primare. Ea a dezvoltat un ulcer exudativ care nu se vindecă la locul biopsiei și s-a prezentat la unitatea hiperbară în martie 2019, când ulcerul măsura 10 mm lățime x 10 mm lungime x 20 mm adâncime (Figura 4). Această rană a fost prezentă timp de 5 luni și a progresat în dimensiune în ciuda pansamentului frecvent de către asistentele din raion.
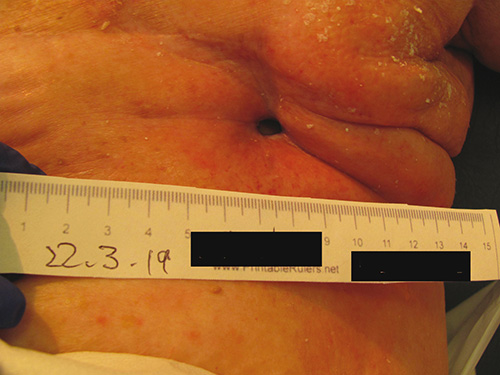
Figura 4. Locul mastectomiei sânului stâng înainte de tratamentul HBOT (plagă situată la mijlocul toracelui – adâncimea sondei 10 mm)
Ea a început HBOT în aprilie 2019 și a avut 60 de tratamente fără incidente pe o perioadă de 5 luni. Fiecare tratament a fost efectuat la 243 kPa timp de 90 de minute pe zi, 5 zile pe săptămână într-o cameră multiloc Fink SL8. Din cauza unor circumstanțe personale, non-medicale, HBOT a fost întreruptă timp de 2 luni la jumătatea cursului ei de tratament. La 8 luni de la prezentarea inițială, rana ei continuă să se îmbunătățească, nefiind nevoie de îngrijire suplimentară a plăgii (Figura 5).
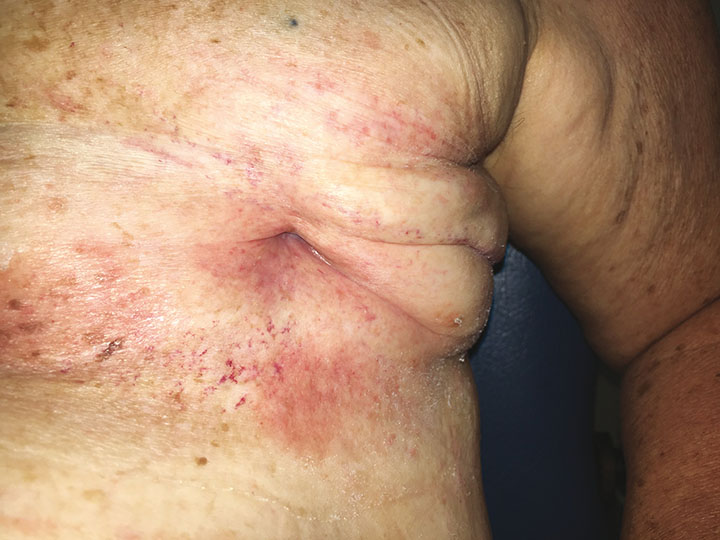
Figura 5. Locul mastectomiei sânului stâng la 8 luni după prezentarea inițială
Discuţie
Aceste două studii de caz au prezentat răni deteriorate care au fost considerate a necesita o intervenție chirurgicală semnificativă. Scopul trimiterii pentru HBOT a fost de a evita intervenția chirurgicală ulterioară într-un câmp iradiat.
Chimioterapia post-mastectomie poate mai mult decât dubla riscul de pierdere a protezei în comparație cu chimioterapia în monoterapie 2,6 . Cu toate acestea, nu există un consens cu privire la momentul optim pentru radioterapie. O serie de reconstrucții în două etape sugerează că, deși rata eșecului reconstructiv este mai mare pentru pacienții care au radioterapie în momentul expansiunii tisulare, comparativ cu la momentul implantului definitiv, rezultatele estetice sunt mai bune 10 .
Baza HBOT este respirarea oxigenului pur la o presiune parțială mai mare decât presiunea atmosferică, ceea ce duce la crearea unui gradient de oxigen ridicat în câmpul iradiat, declanșând neoangiogeneza. Alte mecanisme benefice ale acțiunii tratamentului HBOT sunt creșterea tensiunii de oxigen a țesuturilor în mod intermitent pentru a optimiza proliferarea fibroblastelor și sinteza colagenului, precum și creșterea capacității de distrugere oxidativă a celulelor albe din sânge pentru a ajuta la combaterea infecțiilor. Neoangiogeneza rezultată și funcția îmbunătățită a fibroblastelor în rana iradiată duce la o vindecare îmbunătățită a rănilor 3 .
În practică, presiunea de rutină a tratamentului este între 206,6 și 243 kPa (2,0–2,4 ATA). La instituția noastră, practica standard pentru tratamentul rănilor induse de radiații este de 40 de tratamente HBOT, fiecare la 243 kPa. Rana este revizuită la 40 de tratamente și, dacă există încă potențialul de îmbunătățire ulterioară, tratamentul poate fi extins până la 60 de tratamente. Această decizie se ia de la caz la caz, ținând cont de potențialele complicații ale miopului, barotraumatismului acut al urechii medii și toxicității oxigenului care pot crește odată cu un număr prelungit de ședințe HBOT. În timpul tratamentelor, niciunul dintre pacienți nu a avut complicații sau efecte secundare.
HBOT s-a dovedit a fi un tratament eficient pentru leziuni tisulare tardive ale radiațiilor într-o gamă largă de țesuturi, inclusiv os, rect și vezică urinară 7,11 . Cu toate acestea, au existat puține cercetări cu privire la efectele HBOT pentru a preveni sau trata complicațiile radioterapiei după intervenția chirurgicală la sân, în special în utilizarea regulată a protezelor în reconstrucția sânilor. Un studiu pe șobolani din 2011 12 a analizat efectele secundare ale radioterapiei asupra implanturilor mamare și a demonstrat că a existat o scădere semnificativă statistic a grosimii capsulei post-HBOT în comparație cu grupul de control, deși acest lucru nu a fost încă confirmat la oameni. Un studiu prospectiv al lui Teguh et al. 13a arătat că edemul mamar persistent, durerea și eritemul la unele femei care au suferit intervenții chirurgicale de conservare a sânilor și radioterapie s-au îmbunătățit toate după HBOT. Nu s-au găsit dovezi ale vreunui efect benefic al HBOT în tratamentul limfedemului brațului după intervenția chirurgicală la sân și radioterapie adjuvantă 14 .
Experiența noastră cu o gamă largă de leziuni tisulare cu radiații tardive a sugerat că cele două cazuri ale noastre au justificat utilizarea unui curs de HBOT în încercarea de a minimiza sau de a evita intervenția chirurgicală ulterioară la acești doi pacienți. Primul caz, deși nu este strict o reconstrucție bazată pe implant, demonstrează problemele leziunii prin radiații în contextul unui implant. Dacă deteriorarea plăgii ar fi continuat, a existat un risc de expunere la implant și necesitatea de îndepărtare a implantului care ar fi dus la un defect cosmetic semnificativ. Rezultatul de succes cu evitarea intervențiilor chirurgicale ulterioare, inclusiv îndepărtarea implantului, poate fi extrapolat la complicațiile plăgii în urma reconstrucțiilor pe bază de implant. Considerăm că, dacă nu ar fi intervenția HBOT, acest implant cu siguranță ar fi trebuit îndepărtat.
În al doilea caz, sinusul cronic s-ar fi putut înrăutăți progresiv, necesitând o intervenție chirurgicală reconstructivă semnificativă pentru corectare. Corecția chirurgicală ulterioară care implică operarea într-un câmp iradiat a fost considerată cu risc ridicat de complicații ulterioare. Acest lucru a fost evitat cu succes cu HBOT.
Chiar dacă recentul studiu HOT2 15 nu a arătat nicio îmbunătățire cu HBOT în radionecroza țesuturilor moi a intestinului, cele două cazuri sugerează o îmbunătățire clară și salvarea implantului după HBOT în răni care altfel ar fi fost susceptibile de a necesita o intervenție chirurgicală majoră.
Concluzie
Tratamentul rănilor mamare induse de radiații poate fi dificil, mai ales dacă există riscul expunerii la implant. Înainte de prezentare, ambii pacienți au avut răni înrăutățite, în ciuda îngrijirii regulate a plăgii. HBOT nu numai că a contribuit în mod semnificativ la vindecarea rănilor, dar a avut și un impact mare asupra calității vieții pentru ambele femei, reducând nevoia de schimbări multiple de pansament în fiecare săptămână și evitând necesitatea unei intervenții chirurgicale reconstructive semnificative.
Aceste cazuri susțin argumentul potrivit căruia HBOT are un rol și ar trebui luate în considerare în tratarea deteriorării plăgii în urma intervenției chirurgicale de conservare a sânilor sau a mastectomiei totale cu sau fără reconstrucție după radioterapie. Deși numărul nostru este mic, evitarea complicațiilor grave desfigurante și a intervențiilor chirurgicale îndelungate justifică un studiu prospectiv multicentric mai amplu care să analizeze eficacitatea HBOT în salvarea implantului.
Conflict de interese
Autorii declară că nu există conflicte de interese.
Finanțarea
Autorii nu au primit finanțare pentru acest studiu.
Drepturi de autor
Toate cifrele drepturi de autor ale Hyperbaric Health sunt folosite cu permisiune.
Autor(i)
Yasantha Rajapakse*
MBChB FRACS
Concepte noi Chirurgie plastică, Bondi Junction, NSW
Email yosanta@yahoo.com
Glen C Hawkins
MBChB, FANZCA, DipAdvDHM
Hyperbaric Health, Mascot, NSW
* Autorul corespunzator
Referințe
- National Comprehensive Cancer Network. Ghiduri de practică clinică în oncologie: cancerul de sân V.2; 2015. Disponibil la: http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf
- Kronowitz SJ, Robb GL. Radioterapia și reconstrucția sânilor: o revizuire critică a literaturii. Plast Reconstr Surg 2009;124(2):395–408. doi:10.1097/PRS.0b013e3181aee987. PMID:19644254
- Marx RE. Leziuni ale țesuturilor cauzate de radiații. În: Kindwall EP, editor. Practică de medicină hiperbară, ed. a IV-a. Flagstaff: Best Publishing; 2017. str. 727–776.
- Feldmeier JJ. Terapia cu oxigen hiperbaric și leziuni întârziate prin radiații (țesuturi moi și necroză osoasă): actualizare 2012. Undersea Hyperb Med 2012;39(6):1121–39. PMID: 23242770
- Patel KM, Albino F, Fan KL, Liao E, Nahabedian MY. Reconstrucția microvasculară autologă a sânilor în contextul radioterapiei: compararea a doi algoritmi reconstructivi. Plast Reconstr Surg 2013;132(2):251–7. doi:10.1097/PRS.0b013e31829586e2. PMID:23897324
- Lam TC, Borotkanics R, Hsieh F, Salinas J, Boyages J. Eșec imediat al reconstrucției mamare protetice în două etape: radiația nu este singurul vinovat. Plast Reconstr Surg 2018;141(6):1315–24. doi:10.1097/PRS.0000000000004358. PMID:29750759
- Bennett MH, Feldmeier J, Hampson N, Smee R, Milross C. Terapia cu oxigen hiperbaric pentru leziunea târzie a țesutului cu radiații. Cochrane Database Syst Rev 2012(5):CD005005. doi:10.1002/14651858.CD005005.pub4.
- Enomoto M, Yagishita K, Okuma K, Oyaizu T, Kojima Y, Okubo A, et al. Terapia cu oxigen hiperbaric pentru un ulcer cutanat refractar după mastectomie radicală și radioterapie: raport de caz. J Med Case Rep 2017;11(1):5 doi:10.1186/s13256-016-1168-0. PMID: 28049509. PMCID:PMC5209955
- Snyder SM, Beshlian KM, Hampson NB. Oxigen hiperbaric și mamoplastie de reducere la sânul iradiat anterior. Plast Reconstr Surg 2010;125(6):255e–7e. doi:10.1097/PRS.0b013e3181cb67d0. PMID: 20517072
- Cordeiro PG, Albornoz CR, McCormick B, Hudis CA, Hu Q, Heerdt A, et al. Care este momentul optim al radioterapiei postmastectomie în reconstrucția protetică în două etape: radiații către expansorul tisular sau implantul permanent? Plast Reconstr Surg 2015;135(6):1509–17. doi:10.1097/PRS.0000000000001278. PMID 25742523. PMCID:PMC5004350
- Tahir AR, Westhuyzen J, Dass J, Collins MK, Webb R, Hewitt S și colab. Terapia cu oxigen hiperbaric pentru leziunile tisulare cronice induse de radiații: cel mai mare studiu din Australasia. Asian Pac J Clin Oncol 2015;11(1):68–77. doi:10.1111/ajco.12289. PMID 25382755
- Tumerdem-Ulug B, Kuran I, Ozden BC, Mete O, Kemikler G, Aktas S, et al. Administrarea de oxigen hiperbaric înainte sau după iradiere scade efectele secundare ale iradierii pe locurile implantului? Ann Plast Surg 2011;67(1):62–7. doi:10.1097/SAP.0b013e3181e6cfa4. PMID 21301311
- Teguh DN, Bol Raap R, Struikmans H, Verhoef C, Koppert LB, Koole A, et al. Terapia cu oxigen hiperbaric pentru toxicitatea tisulară indusă de radiații tardive: măsuri de rezultat raportate prospectiv de pacient la pacienții cu cancer de sân. Radiat Oncol 2016;11(1):130. doi:10.1186/s13014-016-0700-0. PMID: 27682427. PMCID:PMC5041335
- Gothard L, Haviland J, Bryson P, Laden G, Glover M, Harrison S și colab. Studiu randomizat de fază II a terapiei cu oxigen hiperbaric la pacienții cu limfedem cronic de braț după radioterapie pentru cancer. Radiother Oncol 2010;97(1):101–7. doi:10.1016/j.radonc.2010.04.026. Epub 2010 mai 31. Errata în: Radiother Oncol 2011 Feb;98(2):285. PMID 20605648
- Glover M, Smerdon G, Andreyev HJ, Benton BE, Bothma P, Frith O și colab., Oxigen hiperbaric pentru pacienții cu disfuncție cronică intestinală după radioterapie pelvină (HOT2). Lancet Oncol 2016 Feb;17(2):224–233. doi:10.1016/S1470-2045(15)00461-1. PMID: 26703894. PMCID: PMC4737893