- Elisabeta I. Buchbinder ,Janice P. Dutcher ,Gregory A. Daniels ,Brendan D. Curti ,Sapna P. Patel ,Shernan G. Holtan ,Gerald P. Miletello ,Mayer N. Fishman ,Rene Gonzalez ,Joseph I. Clark ,John M. Richart ,Christopher D. Lao ,Scott S. Tykodi ,Ann W. Silk & David F. McDermott
Jurnal pentru Imunoterapie a Cancerului volum 7 , Număr articol: 49 ( 2019 ) Citați acest articol
Abstract
fundal
Melanomul metastatic (mM) și carcinomul cu celule renale (mRCC) sunt adesea tratate cu terapie pe bază de anti-PD-1, totuși nu toți pacienții răspund și sunt necesare terapii suplimentare. Doza mare de interleukina-2 (HD IL-2) poate duce la răspunsuri durabile la un subgrup de pacienți mM și mRCC. Eficacitatea și toxicitatea terapiei cu HD IL-2 după terapia anti-PD-1 sau anti-PD-L1 nu au fost încă explorate.
Metode
Rapoartele privind pacienții cu mM și mRCC care au primit HD IL-2 după inhibarea PD-1 sau PD-L1 au fost interogate din baza de date PROCLAIM SM . Au fost analizate caracteristicile pacientului, toxicitatea și eficacitatea.
Rezultate
Un total de 57 de pacienți (40 mM, 17 mRCC) au fost tratați cu doze mari de IL-2 după inhibarea PD-1 sau PD-L1 și au avut date înregistrate în baza de date PROCLAIM. Cea mai bună rată generală de răspuns la HD IL-2 a fost de 22,5% pentru mM (4 răspunsuri complete (CR), 5 răspunsuri parțiale (PR)) și 24% pentru mRCC (2 CR, 2 PR). Toxicitatea legată de HD IL-2 observată la acești pacienți a fost similară cu cea observată la pacienții tratați cu HD IL-2 fără blocarea prealabilă a punctului de control. Un pacient care a primit anterior blocare PD-L1 a dezvoltat pneumonită indusă de medicamente cu HD IL-2 care necesită terapie cu steroizi.
Concluzie
În această analiză retrospectivă, terapia cu HD IL-2 a afișat activitate antitumorală durabilă la pacienții cu mM și mRCC care au progresat în urma tratamentului cu inhibarea PD-1 și PD-L1. Toxicitățile au fost, în general, gestionabile și în concordanță cu așteptările de la HD IL-2, dar medicii ar trebui să fie atenți la toxicitățile legate de sistemul imunitar, cum ar fi pneumonita. Această analiză sprijină dezvoltarea unor studii prospective randomizate pentru a evalua secvențierea adecvată și combinația dintre blocarea punctelor de control imun și terapia cu citokine.
fundal
Imunoterapia se extinde rapid în tratamentul a numeroase afecțiuni maligne. Una dintre cele mai timpurii imunoterapii, interleukina-2 în doză mare (HD IL-2), activează celulele T și a documentat răspunsuri tumorale durabile la un subgrup de pacienți cu mM și mRCC. [ 1 , 2 , 3 ] Cu toate acestea, profilul de toxicitate acută și cerințele pentru managementul intensiv al pacientului internat au limitat aplicarea IL-2 HD, iar blocarea punctelor de control imun (ICB) l-a înlocuit în mare măsură ca tratament de primă linie al mM și mRCC avansat. [ 4 ]
Ipilimumab, a demonstrat beneficii în melanomul metastatic (mM) ca agent unic și acum în combinație cu alți agenți de imunoterapie. Inhibarea PD-1 cu nivolumab sau pembrolizumab a fost și mai eficientă, ceea ce a condus la aprobarea FDA în mM, carcinomul cu celule renale (mRCC) și alte câteva afecțiuni maligne. [ 5 , 6 , 7 , 8 , 9 , 10 ] Cu toate acestea, terapii alternative sunt necesare pentru pacienții care dezvoltă reacții adverse severe, progresează după un răspuns inițial sau nu răspund la ICB.
Domeniul este plin de studii clinice cu agenți noi care vizează punctele de control imunitar, terapii injectabile, cum ar fi virușii antitumorali, terapii bazate pe celule T, inclusiv TIL (limfocitul infiltrat tumoral) și celulele CAR-T (celule T cu receptorul antigen himeric) în monoterapie și in combinatie. Odată cu această explozie de interes pentru imunoterapie, a fost reînnoit interesul pentru citokine și rolul lor în stimularea imună și depășirea rezistenței la inhibarea punctelor de control. Medicamente noi care vizează receptorul IL-2 sunt în studii clinice.
Domeniul imunoterapiei are acum sarcina de a găsi tratamente adecvate pentru pacienții care nu beneficiază de ICB. Studiile clinice care implică agenți individuali și combinații necesită date generatoare de ipoteze, precum și experiență clinică pentru a ajuta la ghidarea progresului în acest domeniu.
În acest studiu, am interogat baza de date PROCLAIM pentru pacienții cu mM sau mRCC care au dezvoltat rezistență la inhibarea PD-1/PD-L1 și au fost ulterior tratați cu HD IL-2 pentru a examina eficacitatea, toxicitatea și rezultatele pe termen lung ale acesteia. setarea de salvare. De asemenea, am interogat baza de date pentru pacienții tratați cu HD IL-2 care nu au primit anterior inhibare PD-1 sau PD-L1 ca grup de comparație.
Metode
Pacienții
Registrul PROCLAIM este o bază de date cu pacienți, din mai mult de 40 de centre comunitare și mari academice, care au primit HD IL-2 în tratamentul mM sau mRCC ( Clinicaltrials.gov : NCT 01415167) Studiul a fost aprobat de comitetele de revizuire instituționale ale site-urile care înscriu subiecții și toți pacienții au furnizat consimțământul scris și informat. Pentru acest studiu, registrul a fost interogat pentru a identifica pacienții tratați cu HD IL-2 înainte sau după inhibarea PD-1 sau PD-L1. Au fost analizate caracteristicile pacientului, inclusiv vârsta, sexul, tipul bolii, numărul și tipul de terapii anterioare și răspunsurile anterioare la terapie prin evaluarea medicului curant. În plus, au fost raportate doza, răspunsul și toxicitatea IL-2.
Tratament
HD IL-2 a fost administrat conform standardului de îngrijire al instituției tratante ca regim de spitalizare, utilizând de obicei o perfuzie IV de 600.000 UI/kg sau 720.000 UI/kg la fiecare 8 ore, conform toleranței, până la 14 doze consecutive timp de 5 zile. Baza de date a capturat până la 3 toxicități care au condus la întreruperea tratamentului cu IL-2 per pacient. Acei pacienți care au fost internați pentru a doua săptămână/ciclu de tratament, s-au întors după aproximativ 9 zile de pauză. Două săptămâni de terapie cu HD IL-2 au constituit un curs de tratament. Unii pacienți au primit cursuri suplimentare de terapie la discreția medicului curant.
Date de răspuns și toxicitate
Este raportat numărul de pacienți care au obținut un răspuns complet (RC), răspunsuri parțiale (PR), boală stabilă (SD) și boală progresivă (PD) la evaluarea inițială după HD IL-2, așa cum a fost determinat de medicul curant folosind RECIST 1.1. . În plus, sunt raportate, de asemenea, cel mai bun răspuns global, rata de răspuns obiectiv (ORR) și supraviețuirea globală mediană (OS). Cel mai bun răspuns global este cel mai bun răspuns înregistrat de la începutul tratamentului HD IL-2 până la progresia/recurența bolii sau inițierea unei noi terapii anticancer. Obiectivele de răspuns și de supraviețuire au fost măsurate de la începutul terapiei cu IL-2 HD și au fost comparate între pacienții care au primit și cei care nu au primit anterior terapie PD-1 sau PD-L1. Toxicitățile și toxicitățile legate de imun au fost examinate la pacienții care au primit IL-2 după inhibarea PD-1 sau PD-L1 și au fost comparate cu subiecții care au primit IL-2 HD fără ICB anterior.
analize statistice
Toate analizele statistice au fost efectuate folosind software-ul SAS versiunea 9.4 (SAS Institute, Cary, NC). Numărările de frecvență și măsurile de tendință centrală au fost efectuate pentru a furniza statistici descriptive; au fost raportate mediane cu valorile minime și maxime. Curbele Kaplan-Meier cu intervale de încredere (IC) de 95% au fost utilizate pentru a estima supraviețuirea globală mediană (mOS) și supraviețuirea fără progresie (PFS). Timpul total de supraviețuire a fost calculat de la data primei doze de HD IL-2 până la data morții sau la data celei mai recente urmăriri. PFS a fost calculată de la data primei doze de HD IL-2 până la data progresiei mM sau mRCC sau începerea unui nou tratament anti-cancer.
Rezultate
Caracteristicile pacientului
Un total de 57 de pacienți (40 mM, 17 mRCC) au fost identificați în registrul PROCLAIM care au primit doze mari de IL-2 în urma tratamentului cu inhibarea PD-1 sau PD-L1. Alți 1122 mM și mRCC pacienți au fost identificați în registru care au fost tratați cu HD IL-2 fără ICB prealabil.
Dintre pacienții cu mM, 18 au primit inhibare PD-1 cu nivolumab, 17 cu pembrolizumab, iar restul au primit inhibare PD-1 fără identificarea medicamentului. Patru pacienți mM au primit combinație de nivolumab și ipilimumab. Dintre pacienții cu mRCC, 8 au primit inhibarea PD-1 cu nivolumab și 1 a primit pembrolizumab. Trei pacienți cu mRCC au primit inhibare PD-L1 cu atezolizumab, iar restul au primit inhibare PD-1 fără identificarea medicamentului. Este posibil ca pacienții să fi primit mai mult de un agent țintă PD-1 sau PD-L1. Pacienții au fost predominant bărbați cu status de performanță ECOG de 0 sau 1 și aveau mai mult sau egal cu 3 locuri de boală metastatică (Fișier suplimentar 1 : Tabelul S1). LDH medie a fost de 336,5 (117–904) la pacienții cu mM.
Starea mutațională a fost raportată pentru 25% din toți pacienții cu 40 mM. Dintre acei pacienți la care a fost raportată starea mutațională, 4 au fost observați ca fiind mutanți BRAF, 5 au fost observați ca fiind mutanți NRAS și unul a avut o mutație cKIT. Dintre pacienții cu mM, șapte au avut anterior terapie cu inhibitori BRAF. Dintre pacienții cu mRCC, șase au avut anterior terapie cu inhibitori ai tirozin kinazei anti-VEGF.
Timpul mediu dintre diagnosticul bolii metastatice și inițierea HD IL-2 a fost de 22,4 (0,8–55,8) luni pentru pacienții cu mM și 31,8 (0,2–156,0) luni pentru pacienții cu mRCC. Durata medie a tratamentului pentru HD IL-2 (inclusiv perioadele de repaus) a fost de 2,1 (0,1–7,3) luni la pacienții cu mM și 1,8 (0,1–6,1) la pacienții cu mRCC. Toți pacienții au avut progresia bolii înainte de a începe tratamentul cu HD IL-2.
Timpul mediu dintre finalizarea terapiei PD-1/PD-L1 și începerea HD IL-2 a fost de 6,3 (0,3–28,1) luni pentru pacienții cu mM și de 2,1 (0,4–7,4) luni pentru pacienții cu mRCC. În medie, pacienții cu mM au fost tratați cu PD-1/PD-L1 pentru o medie de 5,4 (1,5-27,5) luni și 9,3 (0,7-31,2) luni la pacienții cu mRCC. La pacienții cu mM, investigatorul a raportat că datele de răspuns la terapia PD-1/PD-L1 au fost disponibile pentru 29 de pacienți, toți având PD. Dintre pacienții cu mRCC, investigatorul a raportat că datele de răspuns la terapia PD-1/PD-L1 au fost disponibile pentru 12 pacienți, un pacient a avut o PR inițială, dar în cele din urmă a progresat și 11 pacienți au avut PD.
Toxicitate
Evenimentele adverse raportate înainte de inițierea HD IL-2 includ un pacient mM și un mRCC cu testări ale funcției hepatice crescute înainte de inițierea HD IL-2. Toxicitatea anterioară pentru PD-1 și PD-L1 a fost înregistrată retroactiv, astfel încât unele dintre date pot lipsi.
Hipotensiunea arterială a fost cea mai frecventă toxicitate raportată, care a dus la încetarea HD IL-2. Alte toxicități înregistrate includ tahicardie, diaree, hipoxie, trombocitopenie, friguri, sindrom de scurgere capilară, confuzie, oboseală mentală și prurit. Aceste toxicități sunt în concordanță cu cele observate cu HD IL-2. (Fișier suplimentar 2 : Tabelul S2).
Numărul mediu de doze de IL-2 HD pe ciclu este adesea folosit ca o reflectare a toxicității, deoarece IL-2 este menținută atunci când un pacient are efecte secundare mai severe. Un curs de terapie cu doze mari de IL-2 constă din două cicluri. Pacienții cu mM au primit o medie de 8,1 (SD 2,4) doze de IL-2 pe ciclu. Pacienții cu mRCC au primit o medie de 8,0 (SD 3,0) doze de IL-2 pe ciclu. Dintre pacienții cu mM pentru care au fost disponibile date privind ciclurile, 20% au primit un ciclu, 27,5% au primit două cicluri, 7,5% au primit 3 cicluri, 22,5% au primit 4 cicluri și 12,5% au primit mai mult de 4 cicluri. În cohorta de pacienți mRCC pentru care au fost disponibile date despre ciclu, 12% au primit un ciclu, 35% au primit 2 cicluri, 29% au primit patru cicluri și 12% au primit mai mult de 4 cicluri. (Fișier suplimentar 3 : Tabelul S3).
Baza de date nu a raportat toxicități autoimune la niciunul dintre pacienții cărora li sa administrat HD IL-2 după inhibarea PD-1 sau PD-L1. Cu toate acestea, una dintre instituții a raportat un pacient cu presupusă pneumonită severă în timpul terapiei cu IL-2 HD, care a fost considerată a fi legată de inhibarea anterioară a PD-L1. Acest pacient nu a avut anterior irAE la inhibarea PD-L1. În ziua 7 de tratament, după ce a primit 11 din 14 doze posibile de HD IL-2, a dezvoltat dificultăți de respirație și hipoxie cu o saturație de oxigen de 88%. Imagistica inițială a fost în concordanță cu edem pulmonar de la scurgerea capilară indusă de HD IL-2, totuși starea sa nu s-a îmbunătățit cu diureză și imagistica repetă a arătat agravarea infiltratelor pulmonare sugestive de pneumonită. El a fost tratat cu metilprednisolon intravenos pentru a trata presupusa pneumonită legată de sistemul imunitar și a avut o îmbunătățire marcată a simptomelor, saturației de oxigen și imagistică. Ulterior, el a suferit o reducere a steroizilor cu ameliorare continuă a simptomelor.
Ratele de răspuns și supraviețuirea
Urmărirea mediană a tuturor pacienților după tratamentul cu HD IL-2 a fost de 11,2 (0,3–30,9) luni pentru grupul mM și 11,3 (0,6–29,0) luni pentru grupul mRCC. Dintre pacienții tratați anterior cu inhibarea PD-1/PD-L1, cel mai bun răspuns global raportat la HD IL-2 a fost de 23% (23% în mM și 24% în mRCC), cu 6 pacienți (4 mM și 2 mRCC) un răspuns complet (CR) și 7 pacienți (5 mM și 2 mRCC) care se confruntă cu un răspuns parțial (PR). 38% dintre pacienții cu mM și 47% dintre pacienții cu mRCC au avut boală stabilă. Datele de răspuns sunt rezumate în Tabelul 1 . Niciunul dintre pacienții cu melanom care au avut un CR nu a progresat în momentul blocării bazei de date, 1-4 ani de urmărire. 3/5 PR în melanom au continuat de la blocarea bazei de date, 1-2 ani de urmărire. Niciunul dintre cei doi pacienți cu mRCC care au avut o RC nu a progresat, timp de doi ani de urmărire. Niciunul dintre cei doi pacienți cu mRCC cu PR nu a progresat, timp de doi ani de urmărire.Tabelul 1 Cel mai bun răspuns la HD IL-2
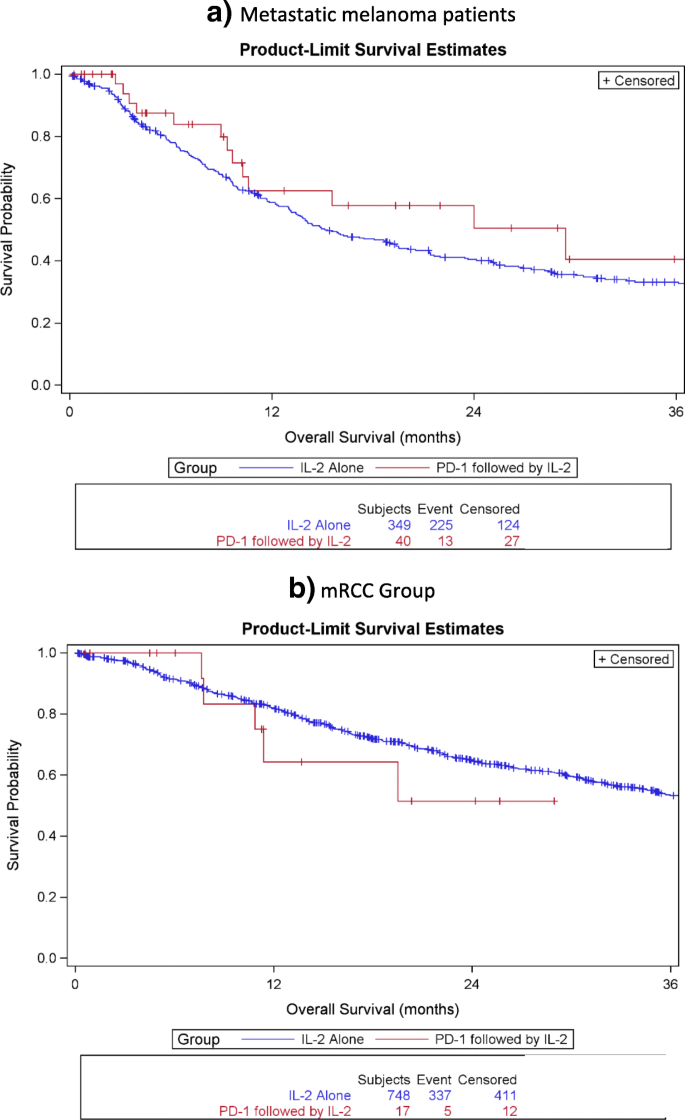
Supraviețuirea globală mediană pentru pacienții cu mM cu ICB anterioară, măsurată de la inițierea administrării HD IL-2, a fost de 29,4 luni, comparativ cu 15,3 luni în grupul HD IL-2 singur. Supraviețuirea globală mediană pentru pacienții cu mRCC cu ICB anterioară nu a fost atinsă în comparație cu 40,8 luni în grupul HD IL-2 singur. Supraviețuirea mediană fără progresie în grupul mM a fost de 3,5 luni, comparativ cu 2,8 luni în grupul HD-IL2 singur și a fost de 8,6 luni în grupul mRCC, comparativ cu 13 luni în grupul HD IL-2 singur. Curbele reprezentative care compară cele două grupuri sunt prezentate în Fig. 1 și 2 .

Discuţie
În această analiză, am examinat modelele de răspuns și toxicitate ale pacienților tratați anterior cu inhibare PD-1 sau PD-L1, care au primit apoi IL-2 HD. Am observat o rată de răspuns la HD IL-2 în concordanță cu cea observată la pacienții care nu fuseseră tratați anterior cu ICB. Deși cohorta de studiu din acest raport este mică, datele sugerează că HD IL-2 este o opțiune viabilă pentru pacienții care au progresat după ICB. De fapt, datele de supraviețuire globală au fost foarte similare pentru pacienții care au primit anterior inhibiție PD-1 sau PD-L1 cu cei care nu au primit. Deoarece acești pacienți au fost tratați în prealabil mai intens, este încurajator faptul că aceste rezultate au fost similare, deși există îngrijorarea că selectăm pacienți cu boală cu progresie mai lent, capabili să primească mai multe tratamente.
Succesul inhibării PD-1 și PD-L1 în oncologie extinde oportunitățile de a explora imunoterapia combinată. HD IL-2 este o țintă atractivă pentru o astfel de explorare, deoarece este o terapie care a documentat eficacitatea antitumorală cu un singur agent și o durată prelungită a răspunsurilor și a supraviețuirii. [ 3 ] În plus, mulți oncologi au deja o experiență vastă cu doze mari de IL-2, permițând administrarea acesteia în condiții de siguranță într-un cadru adecvat. Când a fost studiat pe un model de șoarece al virusului coriomeningitei limfocitare cronice, s-a observat că blocarea PD-L1 face sinergie cu terapia IL-2 pentru a îmbunătăți răspunsurile celulelor T CD8+ și pentru a reduce încărcătura virală. [ 11 ] În plus, un raport de 36 de pacienți care au primit ipilimumab cu IL-2 a demonstrat o rată de răspuns complet de 17% și toxicitate gestionabilă. [ 12 ]
Experiența a demonstrat că imunoterapiile combinate pot avea o toxicitate crescută marcată, așa cum sa observat cu combinația de ipilimumab și nivolumab [ 8 ]. În plus, a fost observată o creștere a toxicității atunci când terapiile cu ipilimumab și nivolumab au fost secvențiate la pacienții cu mM, sugerând efecte reziduale din imunoterapia anterioară. [ 13 ] [ 14 ] În această analiză, nu a existat o tendință evidentă către creșterea toxicității în grupul de pacienți care au primit HD IL-2 după inhibarea PD-1 sau PD-L1. Cu toate acestea, a existat un raport de caz al unui pacient cu presupusă pneumonită indusă de IL-2 care a necesitat terapie cu steroizi. Pneumonita în timpul HD IL-2 nu a fost raportată anterior. HD IL-2 duce la creșterea producției de citokine care duce la stimularea celulelor T. Într-un caz de pneumonită indolentă în care există deja infiltrate imune în plămân, este posibil să existe o exacerbare a reamintirii atunci când terapia anti-PD1 este urmată de HD IL-2. Datorită naturii retrospective a acestei baze de date, o analiză ca aceasta ar putea lipsi alte toxicități imune importante care au fost mai puțin severe, dar importante din punct de vedere clinic.
Unul dintre factorii potențiali care ar putea limita eficacitatea HD IL-2 este acțiunile sale deseori concurente de menținere a celulelor T de reglementare în plus față de celulele T CD8+ și celulele NK care vizează tumorile. Încercările de a depăși acest lucru au condus la dezvoltarea de noi compuși care vizează subunitățile receptorului IL-2. Receptorul IL-2 constă din 3 componente: un lanț α, un lanț β și un lanț γ cu stimulare prin βγ care duce la stimularea unui răspuns imun și stimularea prin αβγ ducând la supresia imună [15 ] . Un nou compus care vizează IL-2Rpγ este NKTR-214 care este testat singur și în combinație cu ICB (NCT02869295, NCT02983045, NCT03138889). ALKS 4230 este o proteină de fuziune a IL-2 permutată circular și o porțiune solubilă a IL-2Ra pentru a preveni semnalizarea prin IL-2Ra care este, de asemenea, în testare clinică (NCT02799095). De asemenea, în testarea clinică sunt FAP-IL-2v și CEA-IL2v, imunocitokinele bazate pe varianta IL-2 (NCT02350673).
Aceste date susțin explorarea continuă a IL-2 HD ca imunoterapie la pacienții cu mM și mRCC. Nu pare să existe un rezultat dăunător pentru utilizarea secvenţială a IL-2 HD după terapia anti-PD-1, iar ORR este cel puţin comparabilă cu studiile cu IL-2 în monoterapie. În prezent, există mai multe studii care combină ICB cu HD IL-2, inclusiv două în mRCC (NCT02989714, NCT0296078) și unul în mM (NCT02748564). În plus, studiile despre noi compuși care vizează IL-2 reprezintă un plus important la explorarea noastră actuală a imunoterapiei și se vor baza pe înțelegerea noastră a semnalizării imune.
Referințe
- Atkins, MB, et al., Terapia cu interleukină 2 recombinată cu doze mari pentru pacienții cu melanom metastatic: analiza a 270 de pacienți tratați între 1985 și 1993 . J Clin Oncol, 1999. 17(7): p. 2105–2116.
- Fyfe G, şi colab. Rezultatele tratamentului a 255 de pacienți cu carcinom cu celule renale metastatic care au primit terapie cu interleukină-2 recombinată în doze mari. J Clin Oncol. 1995;13(3):688–96.Articol CAS Google Academic
- Clark J, Curti BD, Davis E, Kaufman H, Amin A, Alva A, Logan T, Hauke R, Miletello G, Vaishampayan U, Johnson D, White R, Wiernik P, Dutcher J. Supraviețuirea fără boală pe termen lung ( DFS) la pacienții cu melanom metastatic (mM) și cancer cu celule renale (mRCC) care urmează doze mari de interleukin-s (HD IL2). JITC. 2017;5(Suppl 2):P319.Google Academic
- Kammula US, White DE, Rosenberg SA. Tendințe în siguranța administrării în bolus de interleukin-2 în doze mari la pacienții cu cancer metastatic. Cancer. 1998;83(4):797–805.Articol CAS Google Academic
- Hodi FS, et al. Supraviețuirea îmbunătățită cu ipilimumab la pacienții cu melanom metastatic. N Engl J Med. 2010;363(8):711–23.Articol CAS Google Academic
- Postow MA, şi colab. Nivolumab și ipilimumab versus ipilimumab în melanomul netratat. N Engl J Med. 2015;372(21):2006–17.Articol Google Academic
- Topalian SL, et al. Supraviețuire, remisiune durabilă a tumorii și siguranță pe termen lung la pacienții cu melanom avansat cărora li se administrează nivolumab. J Clin Oncol. 2014;32(10):1020–30.Articol CAS Google Academic
- Larkin J, şi colab. Nivolumab și Ipilimumab combinat sau monoterapie în melanomul netratat. N Engl J Med. 2015;373(1):23–34.Articol Google Academic
- Robert C, şi colab. Tratamentul anti-receptor de moarte programat-1 cu pembrolizumab în melanomul avansat refractar la ipilimumab: o cohortă randomizată de comparare a dozelor a unui studiu de fază 1. Lancet. 2014;384(9948):1109–17.Articol CAS Google Academic
- Motzer RJ, et al. Nivolumab versus Everolimus în carcinomul renal avansat. N Engl J Med. 2015;373(19):1803–13.Articol CAS Google Academic
- West EE, și colab. Blocarea PD-L1 face sinergie cu terapia IL-2 în revigorarea celulelor T epuizate. J Clin Invest. 2013;123(6):2604–15.Articol CAS Google Academic
- Prieto PA, et al. Blocarea CTLA-4 cu ipilimumab: urmărire pe termen lung a 177 de pacienți cu melanom metastatic. Clin Cancer Res. 2012;18(7):2039–47.Articol CAS Google Academic
- Weber JS, și colab. Administrarea secvenţială de nivolumab şi ipilimumab cu o schimbare planificată la pacienţii cu melanom avansat (CheckMate 064): un studiu deschis, randomizat, de fază 2. Lancet Oncol. 2016;17(7):943–55.Articol CAS Google Academic
- Clark JI și colab. Un studiu multicentric de fază II al interleukinei-2 în doze mari secvențiate cu vemurafenib la pacienții cu melanom metastatic pozitiv cu mutația BRAF-V600. J Imunalt cancer. 2018;6(1):76.Articol Google Academic
- Taniguchi T, Minami Y. Sistemul receptor IL-2/IL-2: o privire de ansamblu actuală. Celulă. 1993;73(1):5–8.Articol CAS Google Academic
Finanțarea
Suport de cercetare oferit de Prometheus Laboratories, Inc.
Disponibilitatea datelor și materialelor
Seturile de date generate și analizate în timpul studiului curent sunt disponibile prin baza de date PROCLAIM.
Informatia autorului
Autori și afilieri
- Dana Farber Cancer Institute, Boston, MA, SUAElisabeta I. Buchbinder
- Fundația de Cercetare a Cancerului din NY, Chappaqua,, NY, SUAJanice P. Dutcher
- Moores UCSD Cancer Center, La Jolla, San Diego, CA, SUAGregory A. Daniels
- Providence Health & Services, Portland, OR, SUABrendan D. Curti
- Centrul de Cancer MD Anderson al Universității din Texas, Houston, TX, 77030, SUASapna P. Patel
- Universitatea din Minnesota, Minneapolis, MN, SUAShernan G. Holtan
- Clinica de hematologie/oncologie, Baton Rouge, LA, SUAGerald P. Miletello
- Moffitt Cancer Center, Tampa, FL, SUAMayer N. Fishman
- Universitatea din Colorado, Aurora, CO, SUARene Gonzalez
- Loyola University Stritch School of Medicine, Maywood, IL, SUAJoseph I. Clark
- Universitatea Saint Louis, Saint Louis, MO, 63110, SUAJohn M. Richart
- Universitatea din Michigan, Ann Arbor, MI, SUAChristopher D. Lao
- Universitatea din Washington și Centrul de Cercetare a Cancerului Fred Hutchinson, Seattle, WA, SUAScott S. Tykodi
- Rutgers Cancer Institute din New Jersey, New Brunswick, NJ, SUAAnn W. Mătase
- Centrul Medical Beth Israel Deaconess, Boston, MA, SUADavid F. McDermott
Contribuții
EB a analizat și interpretat datele pacientului și a contribuit major la scrierea manuscrisului, JD a analizat datele și a contribuit la scrierea manuscrisului. GD, BC, SP, SH, GM, MF, RG, JC, JR, CL, ST, AS, DM au contribuit cu datele pacientului la analiză și au citit și au aprobat manuscrisul final.
autorul corespunzator
Declarații de etică
Aprobarea etică și acordul de participare
Studiul a fost aprobat de consiliile de revizuire instituționale ale site-urilor care au înrolat subiecții și toți pacienții au furnizat consimțământul scris și informat.
Consimțământ pentru publicare
Nu se aplică.
Interese concurente
EB primește sprijin pentru studii clinice de la BMS și Merck, JD primește venituri de consultanță de la Prometheus, BMS, Tracon, Iovance, Eisai, Merck și Amgen, SH primește venituri de consultanță de la Incyte, AS primește sprijin pentru studii clinice de la BMS și Merck și primește venituri de consultanță de la Merck. JC primește venituri din consultanță de la BMS și Merck. ST primește sprijin pentru studii clinice de la Peloton Therapeutics, Merck, Nektar Therapeutics, Calithera Biosciences, Jounce Therapeutics Pfizer, Genentech, ARGOS Therapeutics și BMS, primește și onorari de consultanță de la Calithera Biosciences, Prometheus Laboratories și Bristol-Myers Squibb. GD, BC, SP, SH, GM, MF, RG, JC, JR, CL ST, AS și DM primesc finanțare instituțională de cercetare de la Prometheus. DM primește onorari de consultanță de la BMS, Pfizer, Merck, Novartis, Eisai, Exelixis, Array, Genentech și Jounce.
Nota editorului
Springer Nature rămâne neutră în ceea ce privește revendicările jurisdicționale din hărțile publicate și afilierile instituționale.
Fișiere suplimentare
Additional file 1: of Therapy with high-dose Interleukin-2 (HD IL-2) in metastatic melanoma and renal cell carcinoma following PD1 or PDL1 inhibitionSkip to figshare navigation
Table 1
Patient Demographics
Characteristic
mM
(N=40)
mRCC
(N=17)
IL-2 Alone [1]
(N=1122)
Age (yr)
Mean (SD)
51.6 (10.26)
54.7 (10.27)
55.0 (10.13)
Median
53.0
55.0
56.0
Range
33-69
35-69
18-84
Gender – no. (%)
Male
20 (50.0)
12 (70.6)
752 (67.0)
Female
17 (42.5)
4 (23.5)
369 (32.9)
Location of metastases – no.
(%)
Adrenal Glands
1 (2.5)
1 (5.9)
23 (2.0)
Bone
8 (20.0)
5 (29.4)
195 (17.4)
Brain
8 (20.0)
2 (11.8)
84 (7.5)
Liver
10 (25.0)
5 (29.4)
194 (17.3)
Lung(s)
19 (47.5)
11 (64.7)
733 (65.3)
Lymph Nodes
15 (37.5)
4 (23.5)
399 (35.6)
Pancreas
1 (2.5)
0 (0.0)
14 (1.1)
Skin
7 (17.5)
1 (5.9)
77 (6.9)
Soft Tissue
9 (22.5)
3 (17.6)
139 (12.4)
Stomach
1 (2.5)
1 (5.9)
3 (0.3)
Other
11 (27.5)
3 (17.6)
203 (18.1)
Number of Sites of Metastases
– no. (%)
1
1 (2.5)
3 (17.6)
418 (37.3)
2
6 (15.0)
3 (17.6)
357 (31.8)
>=3
21 (52.5)
8 (47.1)
276 (24.6)
Time between diagnosis of
metastatic disease and
initiation of IL-2 (months)
Mean (SD)
22.38 (14.76)
31.76 (54.47)
8.24 (16.73)
Median
18.25
8.20
2.61
Range
0.8-55.8
0.2-155.97
0.03-243.34
Therapy at Baseline – no. (%)
Drug Therapy
35 (87.5)
13 (76.5)
351 (31.3)
Radiation
18 (45.0)
4 (23.5)
223 (19.9)
Surgery
26 (65.0)
13 (76.5)
941 (83.9)
Ablative Therapy
1 (2.5)
0 (0.0)
4 (0.4)
Tumor Infiltrating Lymphocytes
2 (5.0)
0 (0.0)
1 (0.1)
Other
1 (2.5)
0 (0.0)
5 (0.4)
Positive Mutation – no. (%)
BRAF
4 (10)
0 (0.0)
118 (10.5)
NRAS
5 (12.5)
0 (0.0)
15 (1.3)
cKIT
1 (2.5)
0 (0.0)
7 (0.7)
Performance Status
0
18 (45.0)
6 (35.3)
750 (66.8)
1
17 (42.5)
7 (41.2)
293 (26.1)
2
0 (0.0)
0 (0.0)
7 (0.6)
1 / 3Downloadfigshare
Additional File 1
Tables S1. Patient Demographics (DOCX 31 kb)
Fișier suplimentar 1:
Tabelele S1. Datele demografice ale pacientului (DOCX 31 kb)
Fișier suplimentar 2:
Tabelele S2. Evenimente adverse care limitează administrarea IL-2 (după frecvență) – materiale suplimentare (DOCX 32 kb)
Fișier suplimentar 3:
Tabelele S3. Durata terapiei cu IL-2 (DOCX 20 kb)
Drepturi și permisiuni
Acces deschis Acest articol este distribuit în conformitate cu termenii licenței internaționale Creative Commons Attribution 4.0 ( http://creativecommons.org/licenses/by/4.0/ ), care permite utilizarea, distribuirea și reproducerea fără restricții în orice mediu, cu condiția să oferiți merită adecvată autorului(i) original(i) și sursei, furnizați un link către licența Creative Commons și indicați dacă s-au făcut modificări. Renunțarea la Creative Commons Public Domain Dedication ( http://creativecommons.org/publicdomain/zero/1.0/ ) se aplică datelor puse la dispoziție în acest articol, cu excepția cazului în care se specifică altfel.
Despre acest articol
Citează acest articol
Buchbinder, EI, Dutcher, JP, Daniels, GA și colab. Terapie cu interleukin-2 în doză mare (HD IL-2) în melanomul metastatic și carcinomul cu celule renale după inhibarea PD1 sau PDL1. j. imunoterapie cancer 7 , 49 (2019). https://doi.org/10.1186/s40425-019-0522-3
- Primit31 octombrie 2018
- Admis31 ianuarie 2019
- Publicat18 februarie 2019
- DOIhttps://doi.org/10.1186/s40425-019-0522-3




